¿Qué es un modelo atómico?
Un modelo atómico es una representación simplificada de la composición y estructura de un átomo. A lo largo de la historia, los científicos han desarrollado diferentes modelos atómicos para comprender cómo están organizados los átomos y cómo interactúan entre sí.
El modelo de Dalton (1803): la base de la teoría atómica
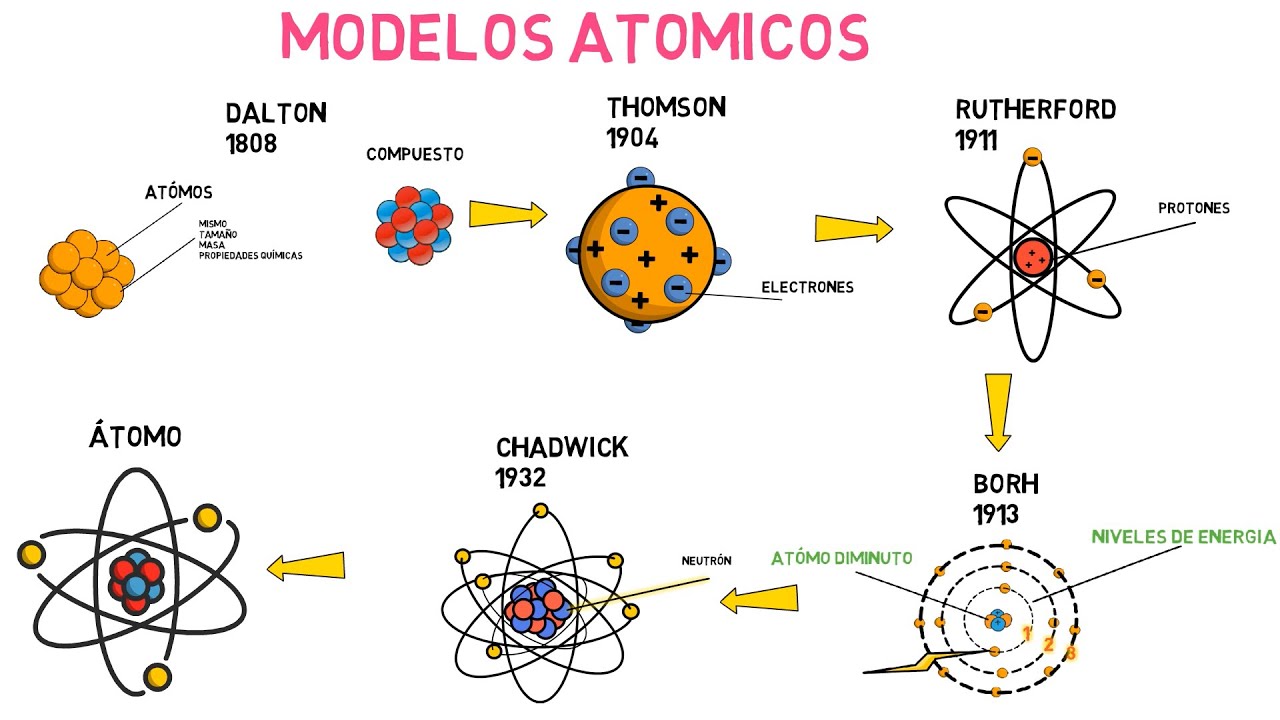
En 1803, John Dalton propuso el primer modelo atómico basado en la teoría atómica. Según Dalton, los átomos eran indivisibles y la materia estaba compuesta por diferentes tipos de átomos que se combinaban en proporciones fijas para formar compuestos químicos. Este modelo sentó las bases de la química moderna y estableció la idea de que los átomos son los constituyentes básicos de la materia.
Avances en el modelo atómico: Thomson y el descubrimiento del electrón
A finales del siglo XIX, el científico británico J.J. Thomson realizó experimentos con tubos de descarga y descubrió la existencia de partículas subatómicas negativas llamadas electrones. Thomson propuso el modelo del «budín de pasas», en el cual los electrones estaban incrustados en una masa positiva, como las pasas en un budín. Este modelo permitió entender la naturaleza eléctrica de los átomos y abrió la puerta a nuevos descubrimientos en la estructura subatómica.
El modelo de Rutherford y el descubrimiento del núcleo atómico
En 1911, Ernest Rutherford, discípulo de Thomson, realizó el famoso experimento de la lámina de oro. Descubrió que la mayoría de las partículas alfa disparadas hacia una lámina de oro pasaban a través de ella, pero algunas eran desviadas o rebotaban. Esto llevó a la conclusión de que los átomos no eran uniformes ni macizos, sino que tenían un núcleo pequeño y denso en el centro, rodeado por electrones orbitales. El modelo de Rutherford fue llamado el «modelo planetario» debido a su similitud con el sistema solar.
El modelo de Bohr y la cuantización de la energía
En 1913, el físico danés Niels Bohr mejoró el modelo de Rutherford introduciendo la idea de que los electrones solo pueden estar en órbitas específicas alrededor del núcleo. Estas órbitas tenían niveles de energía discretos y los electrones no podían ocupar cualquier nivel intermedio. Bohr describió este fenómeno como la «cuantización de la energía». Su modelo proporcionó una explicación para las líneas espectrales observadas en los espectros de emisión y permitió una mejor comprensión de la estructura electrónica de los átomos.
El modelo cuántico y la teoría de la mecánica cuántica
A partir de la década de 1920, los científicos como Erwin Schrödinger y Werner Heisenberg desarrollaron la mecánica cuántica, una teoría matemática que describe el comportamiento de las partículas subatómicas. Este enfoque cuántico reemplazó el modelo de Bohr y proporcionó una descripción más precisa de las propiedades físicas y el comportamiento de los electrones en los átomos. Según este modelo, los electrones no se mueven en órbitas definidas, sino que existen en «nubes» de probabilidad llamadas orbitales.
La era de la física de partículas y el modelo estándar
Desde la década de 1950 hasta la actualidad, la física de partículas ha avanzado rápidamente en el estudio de las partículas subatómicas aún más pequeñas que los átomos. El descubrimiento del electrón, el protón y el neutrón fue solo el comienzo. Ahora sabemos que los protones y neutrones están compuestos por partículas aún más pequeñas llamadas quarks. Además, el modelo estándar de la física de partículas describe las interacciones entre todas las partículas conocidas y las fuerzas fundamentales que gobiernan el universo.
El futuro de los modelos atómicos
Aunque hemos avanzado mucho en nuestra comprensión de la estructura subatómica, aún hay muchas preguntas sin respuesta. Los científicos continúan investigando para comprender mejor la naturaleza de las partículas subatómicas y cómo interactúan. La investigación en el campo de la física de partículas y la cosmología podría proporcionar nuevas perspectivas sobre los modelos atómicos en el futuro.
¿Cómo ha evolucionado la comprensión de los modelos atómicos a lo largo del tiempo?
A medida que avanzamos en la tecnología y desarrollamos nuevas técnicas de investigación, nuestra comprensión de los modelos atómicos se ha vuelto más sofisticada. Desde el modelo de Dalton hasta la mecánica cuántica y el modelo estándar, hemos realizado grandes avances en nuestra comprensión de la estructura subatómica.
¿Cuáles son algunas de las propiedades más importantes de los modelos atómicos?
Los modelos atómicos nos ayudan a comprender cómo los átomos interactúan y cómo se forman los compuestos químicos. También nos permiten describir el comportamiento de las partículas subatómicas y las fuerzas que actúan entre ellas.
¿Cuál es la importancia de comprender los modelos atómicos?
La comprensión de los modelos atómicos es fundamental para muchas áreas de la ciencia y la tecnología. Desde la química hasta la física de partículas y la nanotecnología, los modelos atómicos nos permiten entender cómo funciona el mundo a nivel subatómico y desarrollar aplicaciones prácticas en diversas industrias.
¿Cuál es el siguiente paso en la investigación de los modelos atómicos?
El próximo paso en la investigación de los modelos atómicos es explorar aún más las partículas subatómicas y las fuerzas fundamentales que rigen su comportamiento. Con la tecnología cada vez más avanzada, podemos realizar experimentos más precisos y obtener datos más detallados sobre la estructura subatómica.
La evolución de los modelos atómicos a lo largo del tiempo ha sido un testimonio del ingenio humano y la curiosidad científica. Desde el modelo de Dalton hasta el modelo estándar de la física de partículas, hemos logrado desentrañar muchos de los misterios del mundo subatómico. Sin embargo, aún queda mucho por descubrir y comprender. Los modelos atómicos siguen siendo una parte fundamental de la ciencia y seguirán evolucionando a medida que avancemos en nuestra búsqueda del conocimiento.