¿Qué es la concentración de una solución?
La concentración de una solución es una medida que expresa la cantidad de soluto presente en una determinada cantidad de disolvente. Es una información fundamental en química, ya que nos permite entender y calcular las propiedades de una solución. En esta guía completa del 2021, te mostraremos las mejores formas de expresar la concentración de una solución y cómo utilizar cada una de ellas en diferentes contextos.
¿Por qué es importante conocer las diferentes formas de expresar la concentración de una solución?
Es crucial conocer las diferentes formas de expresar la concentración de una solución para poder realizar cálculos precisos y obtener resultados confiables en el ámbito químico. Cada método de expresión de la concentración tiene sus propias ventajas y desventajas, y puede ser más conveniente utilizar uno u otro dependiendo del contexto. A continuación, te mostraremos los métodos más comunes para expresar la concentración y su utilidad en diferentes situaciones.
Formas comunes de expresar la concentración de una solución
Molaridad (M)
La molaridad es uno de los métodos más utilizados para expresar la concentración de una solución. Se define como la cantidad de moles de soluto presentes en un litro de disolvente. La fórmula para calcular la molaridad es la siguiente: M = moles de soluto / litros de disolvente. Este método es especialmente útil cuando se trabaja con reacciones químicas y se requiere conocer la concentración exacta de una solución.
Molalidad (m)
La molalidad es similar a la molaridad, pero se expresa en moles de soluto por kilogramo de disolvente en lugar de litro. Este método es útil cuando se trabaja con soluciones que experimentan cambios de temperatura significativos, ya que la molalidad no se ve afectada por los cambios en el volumen debido a la dilatación térmica.
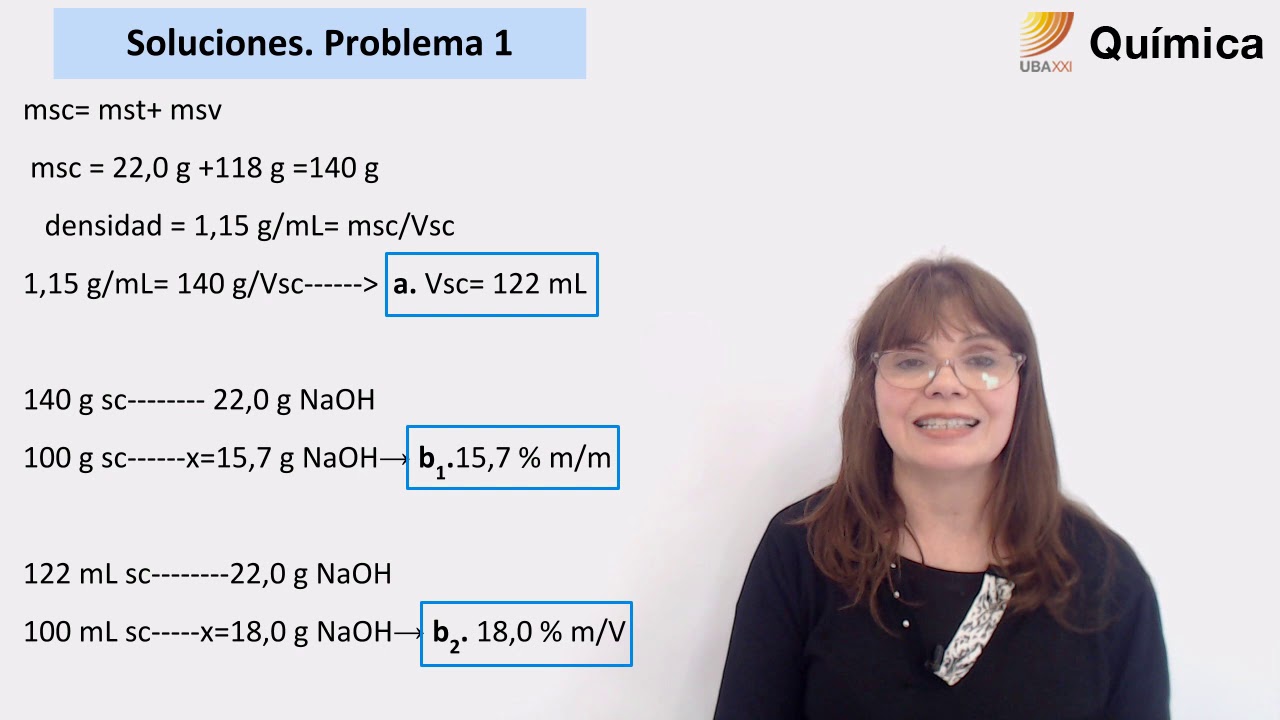
Porcentaje en masa (%)
El porcentaje en masa es uno de los métodos más simples para expresar la concentración de una solución. Se calcula dividiendo la masa del soluto entre la masa total de la solución y multiplicando el resultado por 100. Este método se utiliza comúnmente en soluciones como las soluciones salinas, donde se necesita conocer la concentración de sal en agua.
Fracción molar (χ)
La fracción molar es una medida adimensional que expresa la proporción de moles de soluto respecto al total de moles en una solución. Se calcula dividiendo los moles de soluto entre la suma de los moles de todos los componentes de la solución. La fracción molar es especialmente útil cuando se trabaja con mezclas de soluciones y se requiere conocer la concentración de cada componente.
Normalidad (N)
La normalidad es una medida de concentración similar a la molaridad, pero tiene en cuenta el número de equivalentes del soluto en lugar de los moles. Un equivalente es la cantidad de sustancia que reacciona con un mol de electrones o protones. La fórmula para calcular la normalidad es N = (moles de soluto * número de equivalentes) / litros de disolvente. La normalidad es especialmente útil cuando se trabaja con reacciones de neutralización.
¿Cuál es la mejor forma de expresar la concentración de una solución?
No hay una respuesta única para esta pregunta, ya que la elección del método de expresión de la concentración depende del contexto y los objetivos de la situación en particular. Cada método tiene sus propias ventajas y desventajas, y es importante elegir el más adecuado para el caso específico. Es recomendable consultar con un experto en química o utilizar fórmulas y conversiones adecuadas para obtener resultados precisos.
¿Puedo utilizar diferentes métodos de expresión de la concentración en una misma solución?
Sí, es posible utilizar diferentes métodos de expresión de la concentración en una misma solución. Sin embargo, es importante asegurarse de convertir adecuadamente entre los diferentes métodos para evitar errores en los cálculos.
¿Qué método de expresión de la concentración es más preciso?
La precisión de cada método de expresión de la concentración depende de la situación específica y de las condiciones experimentales. En general, la molaridad y la molalidad son considerados los métodos más precisos, ya que tienen en cuenta el volumen y la temperatura de la solución.
¿Cuál es la diferencia entre la molaridad y la normalidad?
La diferencia entre la molaridad y la normalidad radica en cómo se calculan. Mientras que la molaridad se calcula en base a los moles de soluto y el volumen de disolvente en litros, la normalidad tiene en cuenta el número de equivalentes de soluto, que depende del tipo de reacción química que se esté llevando a cabo.
Esperamos que esta guía completa del 2021 sobre las mejores formas de expresar la concentración de una solución te haya sido útil. Recuerda siempre consultar con expertos en química o utilizar fórmulas y conversiones adecuadas para obtener resultados precisos. ¡Buena suerte en tus experimentos y cálculos químicos!