¿Qué es la Estructura de Lewis del Dióxido de Carbono?
La Estructura de Lewis del Dióxido de Carbono (CO2) es una representación visual de cómo los átomos se unen entre sí mediante enlaces químicos. Fue propuesta por el químico estadounidense Gilbert N. Lewis en 1916 y se utiliza para mostrar la distribución de los electrones en una molécula.
¿Cómo se representa la Estructura de Lewis del CO2?
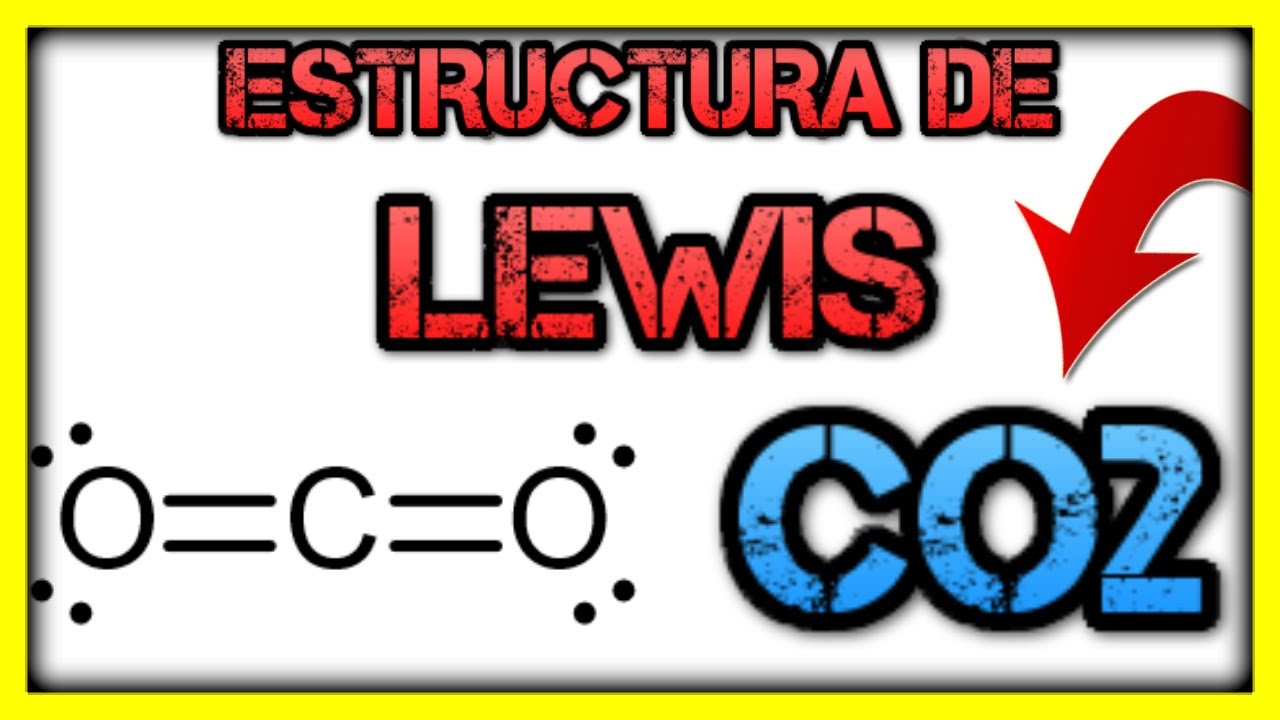
El dióxido de carbono está compuesto por un átomo de carbono (C) y dos átomos de oxígeno (O). La estructura de Lewis muestra los electrones de valencia de cada átomo y los enlaces químicos entre ellos.
Para representar la estructura de Lewis del CO2, primero dibujamos el átomo de carbono en el centro y colocamos los átomos de oxígeno a su alrededor. Luego, distribuimos los electrones de valencia de cada átomo para cumplir con la regla del octeto, que establece que los átomos tienden a completar ocho electrones en su capa de valencia.
El átomo de carbono tiene cuatro electrones de valencia, por lo que se dibujan cuatro puntos o líneas alrededor de él para representar estos electrones. Cada átomo de oxígeno tiene seis electrones de valencia, por lo que se dibujan seis puntos o líneas alrededor de cada uno. Luego, se unen los puntos o líneas para formar enlaces químicos entre el carbono y los átomos de oxígeno.
En el caso del CO2, el carbono forma un enlace doble con cada átomo de oxígeno, lo que significa que comparten dos pares de electrones. Esto se representa mediante líneas dobles entre el carbono y cada oxígeno.
¿Cuál es la importancia de la Estructura de Lewis del CO2?
La Estructura de Lewis del CO2 es importante porque nos permite comprender la geometría de esta molécula y cómo interactúa con otras sustancias químicas. Debido a su estructura lineal y los enlaces dobles carbono-oxígeno, el dióxido de carbono es una molécula no polar.
Esto significa que no tiene una carga eléctrica neta y no es soluble en agua. Además, la estructura de Lewis del CO2 nos ayuda a entender su reactividad química y su participación en el efecto invernadero y el cambio climático.
¿Cómo se pueden representar otras moléculas con la estructura de Lewis?
La estructura de Lewis se puede utilizar para representar la distribución de electrones en muchas otras moléculas. En general, se sigue el mismo procedimiento: se dibujan los átomos y se distribuyen los electrones de valencia para cumplir con la regla del octeto.
Es importante tener en cuenta que la estructura de Lewis es una simplificación y no muestra la forma tridimensional real de las moléculas. Sin embargo, es una herramienta útil para construir modelos mentales e interpretar la química de las sustancias.
¿Pueden los átomos de oxígeno formar enlaces adicionales en la estructura de Lewis del CO2?
No, en la estructura de Lewis del CO2, cada átomo de oxígeno forma un enlace doble con el carbono y cumple con la regla del octeto. No hay electrones de valencia adicionales disponibles para formar enlaces adicionales.
¿Por qué el CO2 es una molécula no polar, a pesar de los enlaces dobles carbono-oxígeno?
A pesar de los enlaces dobles carbono-oxígeno, el dióxido de carbono es una molécula no polar debido a su estructura lineal. Los enlaces y las cargas se equilibran entre los átomos de carbono y oxígeno, lo que resulta en una distribución simétrica de carga eléctrica.
En resumen, la Estructura de Lewis del Dióxido de Carbono es una representación visual que muestra cómo los átomos de carbono y oxígeno se unen mediante enlaces químicos. Esta estructura nos ayuda a comprender la geometría y reactividad del CO2, así como su importancia en fenómenos como el cambio climático. La estructura de Lewis se puede utilizar para representar otras moléculas siguiendo el mismo procedimiento, y aunque es una simplificación, es una herramienta útil en la química.