¿Qué es el estado de la materia?
El estado de la materia se refiere a las distintas formas en las que la materia puede existir: sólido, líquido y gaseoso. Estos estados están determinados por las fuerzas intermoleculares y la energía cinética de las partículas que componen la materia.
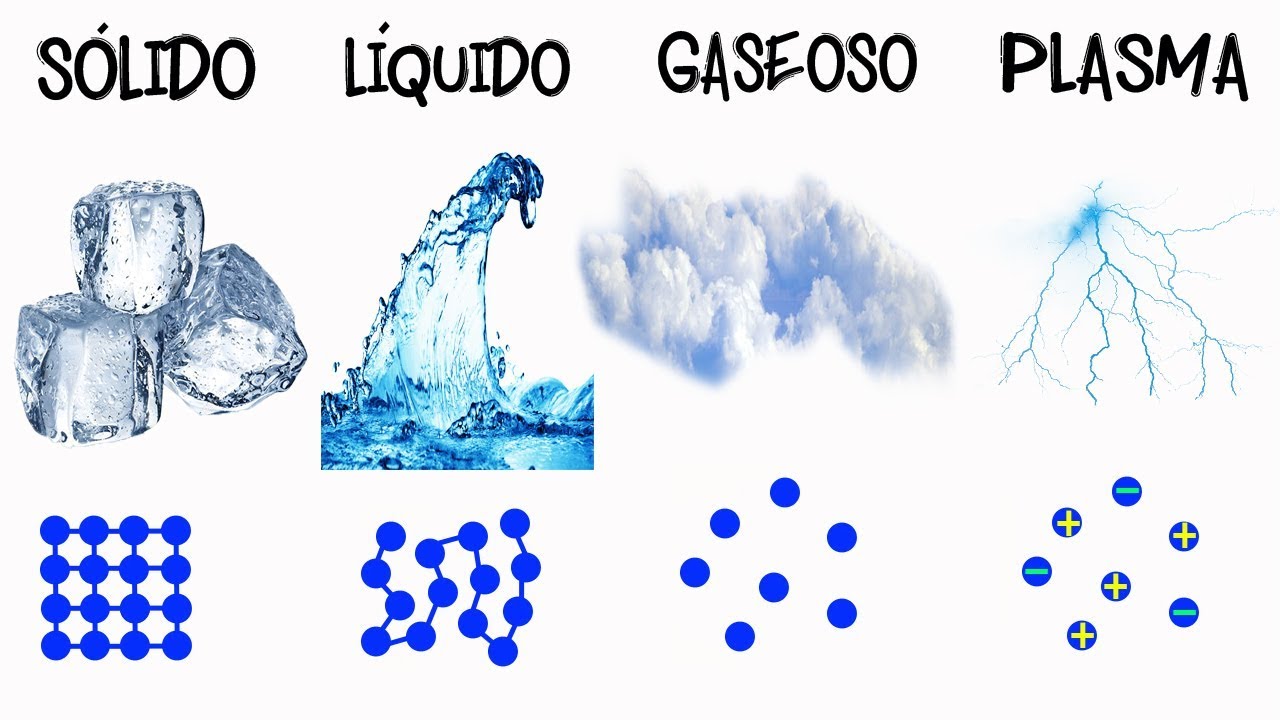
Los sólidos: estructura ordenada y partículas cercanas
El estado sólido se caracteriza por una estructura ordenada en la que las partículas están muy cerca una de otra y tienen una disposición fija. Esto significa que las partículas no se mueven libremente, sino que vibran alrededor de una posición de equilibrio.
Las fuerzas intermoleculares en los sólidos son muy fuertes, lo que contribuye a su estructura compacta. Estas fuerzas mantienen a las partículas unidas y les otorgan una forma y un volumen definidos. Ejemplos comunes de sólidos son el hielo, el hierro y la madera.
Los líquidos: fluidez y partículas más separadas
En estado líquido, las partículas están más separadas que en los sólidos, lo que les permite moverse libremente pero sin separarse completamente. Esto da lugar a la fluidez característica de los líquidos.
Las fuerzas intermoleculares en los líquidos son menos fuertes que en los sólidos, lo que permite que las partículas se desplacen unas alrededor de otras. Aunque tienen forma definida, los líquidos adoptan la forma del recipiente que los contiene. Ejemplos de líquidos comunes son el agua, el aceite y la leche.
Los gases: partículas separadas y gran movilidad
En estado gaseoso, las partículas están muy separadas y tienen gran movilidad. Esto significa que las partículas se mueven libremente en todas las direcciones y tienden a ocupar todo el espacio disponible.
Las fuerzas intermoleculares en los gases son muy débiles, lo que permite que las partículas se muevan de manera independiente y se expandan fácilmente. Los gases no tienen forma ni volumen definidos y se llenan por completo el recipiente que los contiene. Ejemplos de gases son el oxígeno, el hidrógeno y el dióxido de carbono.
La transición entre estados de la materia
Los cambios en la temperatura y la presión pueden causar cambios en el estado de la materia. Por ejemplo, al aumentar la temperatura de un sólido, las partículas obtienen más energía cinética y vibran con mayor amplitud, lo que puede llevar a la fusión y la transición hacia el estado líquido.
Por otro lado, al disminuir la temperatura de un líquido, las partículas pierden energía cinética y se vuelven menos móviles, lo que puede llevar a la solidificación y la transición hacia el estado sólido.
¿Qué es el plasma?
El plasma es un estado de la materia que se encuentra en condiciones extremas de temperatura y energía, como en los rayos o en el interior de las estrellas.
¿Qué es el estado de la materia superfluido?
El estado superfluido ocurre a temperaturas muy bajas, cerca del cero absoluto, y se caracteriza por su fluidez sin viscosidad y su capacidad de fluir hacia arriba a través de recipientes sólidos.
¿Qué es el estado de la materia condensado de Bose-Einstein?
El condensado de Bose-Einstein es un estado de agregación en el que un gran número de partículas subatómicas se comportan como si fueran una sola partícula macroscópica. Este estado se alcanza a temperaturas cercanas al cero absoluto.
¿Qué es el estado vítreo?
El estado vítreo es un estado amorfo de la materia que se encuentra entre el estado sólido y el líquido, en el que las partículas están desordenadas pero todavía no se han fusionado en una estructura cristalina.
¿Qué es la evaporación?
La evaporación es la transición de un líquido hacia el estado gaseoso, que ocurre cuando las partículas individuales del líquido adquieren suficiente energía cinética para escapar de las fuerzas intermoleculares y convertirse en gas.