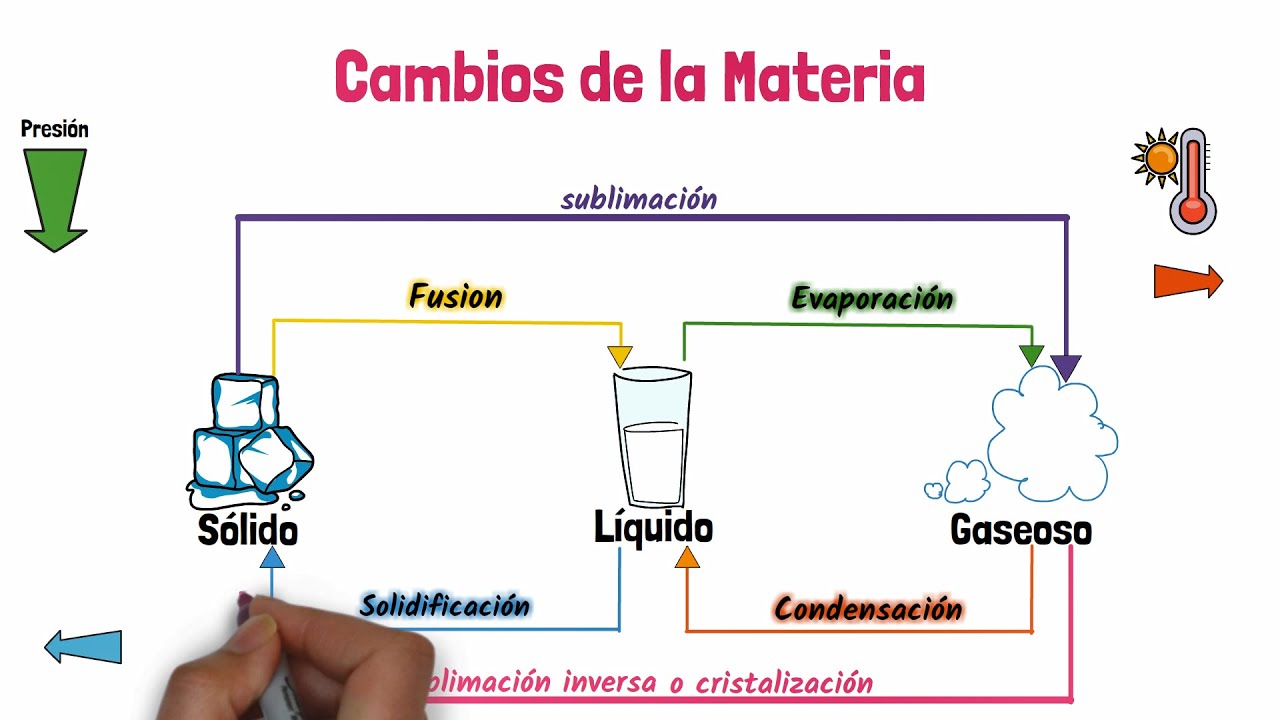
¿Alguna vez te has preguntado qué es lo que sucede cuando la materia cambia de estado? ¿Cómo pueden los sólidos convertirse en líquidos y luego en gases? Los cambios de estado de la materia son un fenómeno fascinante y esencial para comprender la naturaleza de nuestro mundo. En este artículo, te presentaremos una guía práctica que desglosa el esquema completo de los cambios de estado de la materia. Desde los conceptos básicos hasta los detalles más complejos, exploraremos cada etapa y te proporcionaremos información valiosa que te ayudará a comprender este proceso fundamental.
¿Qué es un cambio de estado?
Antes de adentrarnos en los diferentes cambios de estado que puede experimentar la materia, es importante comprender qué es exactamente un cambio de estado. Básicamente, un cambio de estado de la materia se refiere a la transformación física que ocurre cuando una sustancia pasa de un estado a otro, como del estado sólido al estado líquido o del estado líquido al estado gaseoso. Estos cambios están determinados por factores como la temperatura y la presión, y se rigen por principios científicos que explican cómo las partículas individuales interactúan y se mueven en cada estado.
Cambio de estado sólido a líquido: la fusión
La fusión es el primer cambio de estado que exploraremos en esta guía. Sucede cuando un sólido se calienta lo suficiente como para que sus partículas individuales comiencen a vibrar más rápidamente y a separarse, lo que resulta en la formación de un líquido. Pensemos en un cubito de hielo en un vaso de agua: a medida que la temperatura aumenta, el hielo se derrite y se transforma en agua líquida. Este proceso ocurre a una temperatura específica llamada punto de fusión, que difiere para cada sustancia. Durante la fusión, la energía térmica proporcionada a las partículas rompe los enlaces relativamente fuertes que mantenían al sólido unido, permitiendo que las partículas se muevan libremente.
¿Cómo influye la presión en el cambio de estado?
Además de la temperatura, la presión también desempeña un papel importante en los cambios de estado de la materia. Imagina que estás en una montaña muy alta: debido a la baja presión atmosférica, el agua hierve a temperaturas más bajas. En este contexto, el punto de ebullición, que es la temperatura a la cual un líquido pasa al estado gaseoso, se reduce significativamente. Por otro lado, si aumentas la presión sobre un gas, puedes provocar que se condense y se convierta en líquido. La presión tiene un efecto directo en las fuerzas de atracción entre las partículas y, por lo tanto, en su cambio de estado.
Cambio de estado líquido a gaseoso: la evaporación
Cuando calentamos un líquido, su temperatura aumenta y las partículas individuales comienzan a moverse más rápidamente. Si la temperatura alcanza el punto de ebullición de la sustancia, las partículas ganan suficiente energía para superar las fuerzas de atracción intermoleculares y escapar individualmente hacia el estado gaseoso. A este proceso se le llama evaporación. Pensemos en una taza de agua caliente: a medida que calentamos el agua, gradualmente comienza a convertirse en vapor y se evapora en el aire circundante. La evaporación ocurre no solo a la temperatura de ebullición, sino también a temperaturas más bajas. Esto se debe a que algunos de los átomos o moléculas en la superficie líquida tienen suficiente energía térmica para romper las fuerzas de atracción y entrar en el estado gaseoso, creando así una mezcla de partículas líquidas y gaseosas en equilibrio.
¿Qué sucede en el cambio de estado de gas a líquido?
En el cambio de estado de gas a líquido ocurre un proceso inverso al de la evaporación. Cuando un gas se enfría, sus partículas pierden energía y se mueven más lentamente. Cuando la temperatura desciende por debajo del punto de ebullición del gas, las partículas comienzan a agruparse y a formar enlaces más fuertes entre sí, lo que da como resultado la condensación del gas en un líquido. Podemos observar este fenómeno al contemplar las gotas de agua que se forman en el exterior de una botella fría en una día caluroso. La disminución de la energía cinética de las partículas gaseosas hace que se agrupen y formen un líquido.
Cambio de estado sólido a gaseoso: la sublimación
La sublimación es un cambio de estado fascinante, que ocurre cuando un sólido se convierte directamente en gas sin pasar por el estado líquido intermedio. La sublimación puede ocurrir bajo ciertas condiciones específicas de temperatura y presión. Un ejemplo cotidiano de sublimación es el uso de las tabletas de naftalina para desinfectar el armario. Cuando las tabletas sólidas de naftalina están expuestas al aire y la temperatura es lo suficientemente alta, se evaporan sin dejar atrás ningún líquido residual. La sublimación también se puede observar en las regiones polares de la Tierra, donde el hielo seco (dióxido de carbono en estado sólido) se sublima directamente en la atmósfera debido a las bajas temperaturas y la baja presión atmosférica.
Cambio de estado gaseoso a sólido: la deposición
La deposición es el proceso opuesto a la sublimación, en el cual el vapor se deposita directamente en el estado sólido sin pasar por el estado líquido. Esto ocurre cuando un gas se enfría rápidamente, haciendo que sus partículas se condensen y creen un sólido. Un ejemplo de deposición es lo que sucede cuando la niebla se congela en copos de nieve en una fría mañana de invierno. Las partículas de agua en forma de vapor se enfrían rápidamente y se condensan en pequeños cristales de hielo, dando lugar a la formación de la característica estructura hexagonal de los copos de nieve.
En resumen, los cambios de estado de la materia son procesos fundamentales que ocurren en nuestra realidad cotidiana. Desde la fusión de los sólidos hasta la evaporación y la sublimación, cada cambio de estado está influenciado por la temperatura y la presión. La fusión convierte los sólidos en líquidos, la evaporación transforma los líquidos en gases, la sublimación convierte los sólidos directamente en gases y la condensación y la deposición hacen que los gases se conviertan en líquidos y sólidos respectivamente. Comprender estos cambios es esencial para comprender la naturaleza de la materia y el mundo en el que vivimos.
¿Por qué la temperatura de ebullición es diferente para cada sustancia?
La temperatura de ebullición es diferente para cada sustancia debido a las diferentes fuerzas de atracción que existen entre sus partículas. Estas fuerzas pueden variar dependiendo de los enlaces moleculares y las interacciones intermoleculares presentes en cada sustancia. Por ejemplo, el agua tiene una temperatura de ebullición de 100 grados Celsius, mientras que el alcohol tiene una temperatura de ebullición más baja, alrededor de 78 grados Celsius. Estas diferencias se deben a las fuerzas de atracción intermoleculares más fuertes en el agua en comparación con el alcohol.
¿Puede un sólido saltar directamente al estado gaseoso sin pasar por el líquido?
Sí, algunos sólidos pueden sublimar directamente en el estado gaseoso sin pasar por el estado líquido intermedio. Esto ocurre cuando las condiciones de temperatura y presión son adecuadas para facilitar la sublimación. Ejemplos de sustancias que pueden sublimar son el hielo seco (dióxido de carbono sólido), el yodo y la naftalina.
¿Cuál es la diferencia entre evaporación y ebullición?
La evaporación y la ebullición son dos procesos de cambio de estado que ocurren cuando un líquido se convierte en gas. La principal diferencia radica en la temperatura a la que ocurren. La evaporación ocurre a temperaturas más bajas y solo en la superficie del líquido, mientras que la ebullición ocurre en todo el volumen del líquido a una temperatura específica llamada punto de ebullición.
¿Cómo influye la presión en el punto de ebullición de un líquido?
La presión tiene un efecto en el punto de ebullición de un líquido. A mayor presión, se requiere una temperatura más alta para que ocurra la ebullición. Por ejemplo, en las altas montañas, donde la presión atmosférica es baja, el agua hierve a temperaturas más bajas. Esto se debe a que la presión atmosférica ejerce menos fuerza sobre las partículas de agua, lo que permite que puedan escapar y pasar al estado gaseoso a temperaturas más bajas.
¿Qué sucede durante la condensación?
La condensación es el proceso en el que un gas se convierte en líquido al perder energía térmica. Durante la condensación, las partículas de gas pierden energía cinética y se mueven más lentamente, lo que permite que las fuerzas de atracción intermoleculares tengan un efecto mayor. A medida que las partículas se agrupan y forman enlaces más fuertes, se produce la condensación y el gas se convierte en líquido.
¿Cuál es el punto de fusión del agua?
El punto de fusión del agua es de 0 grados Celsius o 32 grados Fahrenheit. A esta temperatura, el hielo se convierte en agua líquida. Es importante tener en cuenta que esta es la temperatura al nivel del mar y puede variar ligeramente dependiendo de la presión atmosférica.