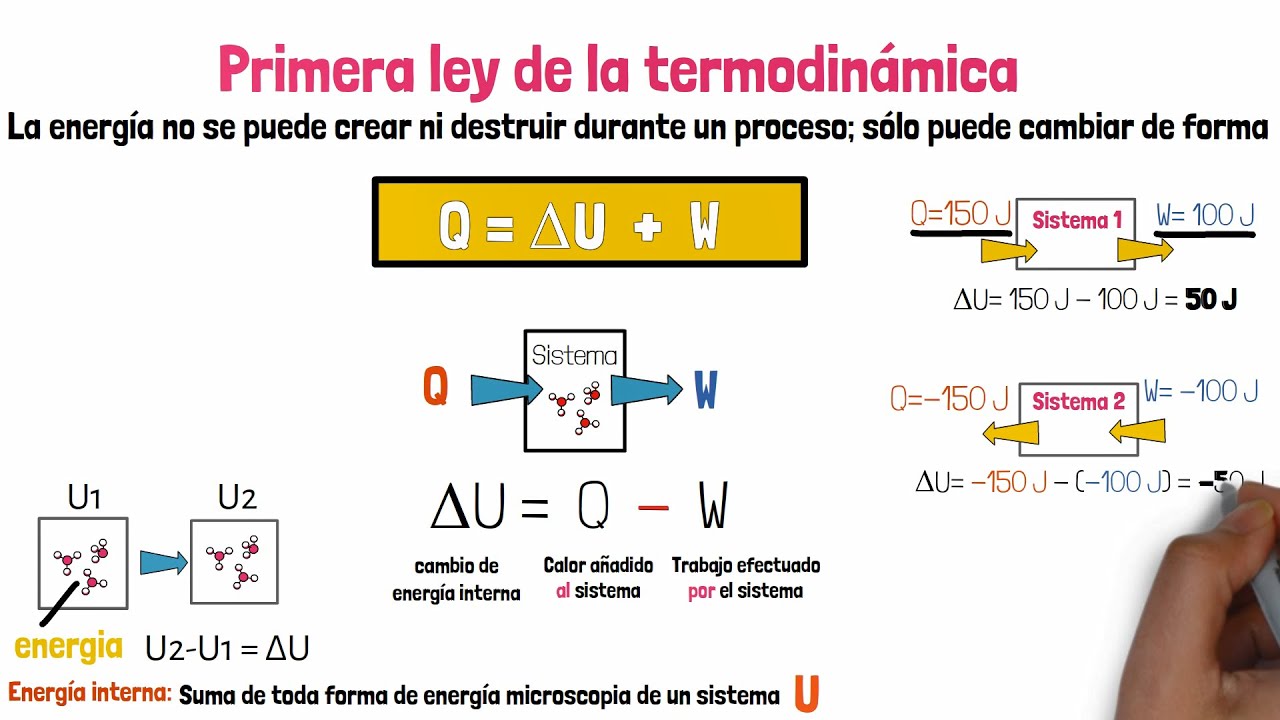
¿Qué es la Primera Ley de la Termodinámica?
La Primera Ley de la Termodinámica, también conocida como la Ley de Conservación de la Energía, es uno de los principios fundamentales de la física y la termodinámica. Esta ley establece que la energía no se crea ni se destruye, solo se transforma de una forma a otra. En otras palabras, la cantidad total de energía en un sistema aislado se mantiene constante.
La Primera Ley de la Termodinámica se basa en la idea de que la energía es una propiedad fundamental del universo y que no puede desaparecer o aparecer de la nada. En cambio, puede cambiar de forma, como de energía cinética a energía potencial, o transferirse de un objeto a otro a través de la transferencia de calor o trabajo.
¿Cómo funciona la Primera Ley de la Termodinámica?
La aplicación de la Primera Ley de la Termodinámica se puede entender mejor a través de un ejemplo sencillo. Imagina un calentador eléctrico que se usa para calentar agua en una tetera. Cuando enciendes el calentador, la energía eléctrica se convierte en energía térmica y calienta el agua en la tetera.
En este caso, la energía eléctrica suministrada al calentador se convierte en energía térmica, pero la cantidad total de energía en el sistema (calentador + agua) se mantiene constante. Si bien el agua se calienta y la temperatura del sistema aumenta, la energía total no cambia.
El principio detrás de esto es que la energía no puede desaparecer ni aparecer de la nada. Se puede transferir de un objeto a otro o transformarse en diferentes formas de energía, pero la cantidad total de energía se mantiene constante en todo el sistema.
La Primera Ley de la Termodinámica en la vida cotidiana
Aunque la Primera Ley de la Termodinámica puede sonar complicada, en realidad es un concepto que encontramos en nuestra vida cotidiana. Por ejemplo, cuando conduces un automóvil, la energía química almacenada en el combustible se convierte en energía mecánica para mover el vehículo.
De manera similar, en un refrigerador, la energía eléctrica se utiliza para extraer el calor del interior y mantener una temperatura más baja. En ambos casos, la energía se transforma de una forma a otra, pero la cantidad total de energía no cambia.
La Primera Ley de la Termodinámica también se aplica a nuestro propio cuerpo. La energía que obtenemos de los alimentos que consumimos se utiliza para realizar diferentes funciones y actividades, como mantener la temperatura corporal, mover los músculos y pensar. En última instancia, la energía que consumimos se transforma y se utiliza en nuestro cuerpo, pero la cantidad total de energía se mantiene constante.
¿Por qué es importante la Primera Ley de la Termodinámica?
La Primera Ley de la Termodinámica es importante porque establece un principio fundamental sobre la conservación de la energía en el universo. Este principio es esencial para comprender y predecir cómo la energía se comporta en diferentes sistemas y procesos.
Aplicaciones prácticas de la Primera Ley de la Termodinámica se encuentran en diversas áreas de la ciencia y la tecnología. Se utiliza en la ingeniería para diseñar sistemas de energía eficientes, en la física para estudiar el movimiento y la transformación de energía, y en la química para entender las reacciones químicas y los cambios de energía.
En resumen, la Primera Ley de la Termodinámica es un concepto fundamental que establece que la energía no se crea ni se destruye, solo se transforma. Esta ley es aplicable a diversos sistemas y procesos en el universo, y su comprensión es crucial para nuestro entendimiento del comportamiento energético en el mundo que nos rodea.
¿La Primera Ley de la Termodinámica se aplica solo a sistemas cerrados?
No, la Primera Ley de la Termodinámica se aplica a sistemas abiertos y cerrados. En un sistema cerrado, no se intercambia materia con el entorno, pero puede haber transferencia de energía en forma de calor o trabajo. En un sistema abierto, tanto la materia como la energía pueden entrar o salir del sistema.
¿Qué significa que la energía se transforma?
La transformación de la energía se refiere al cambio de una forma de energía a otra dentro de un sistema. Por ejemplo, la energía eléctrica se puede transformar en energía térmica, mecánica, lumínica, química, entre otras formas de energía.
¿Cuál es la relación entre la Primera Ley de la Termodinámica y la Segunda Ley de la Termodinámica?
La Primera Ley de la Termodinámica establece la conservación de la energía, mientras que la Segunda Ley de la Termodinámica establece la dirección en la que ocurren los procesos y la tendencia hacia el desorden o la entropía.
¿Existen excepciones a la Primera Ley de la Termodinámica?
En el ámbito macroscópico y en condiciones normales, no se conocen excepciones a la Primera Ley de la Termodinámica. Sin embargo, en escalas microscópicas y en condiciones extremas, como en agujeros negros o en el estudio de partículas subatómicas, pueden surgir fenómenos que desafíen nuestra comprensión actual de esta ley.
¿Quién descubrió la Primera Ley de la Termodinámica?
La Primera Ley de la Termodinámica fue formulada por el físico y matemático alemán Julius Robert von Mayer en la década de 1840. Varios científicos, como James Prescott Joule y Hermann von Helmholtz, también contribuyeron al desarrollo y comprensión de esta ley a lo largo de los años.