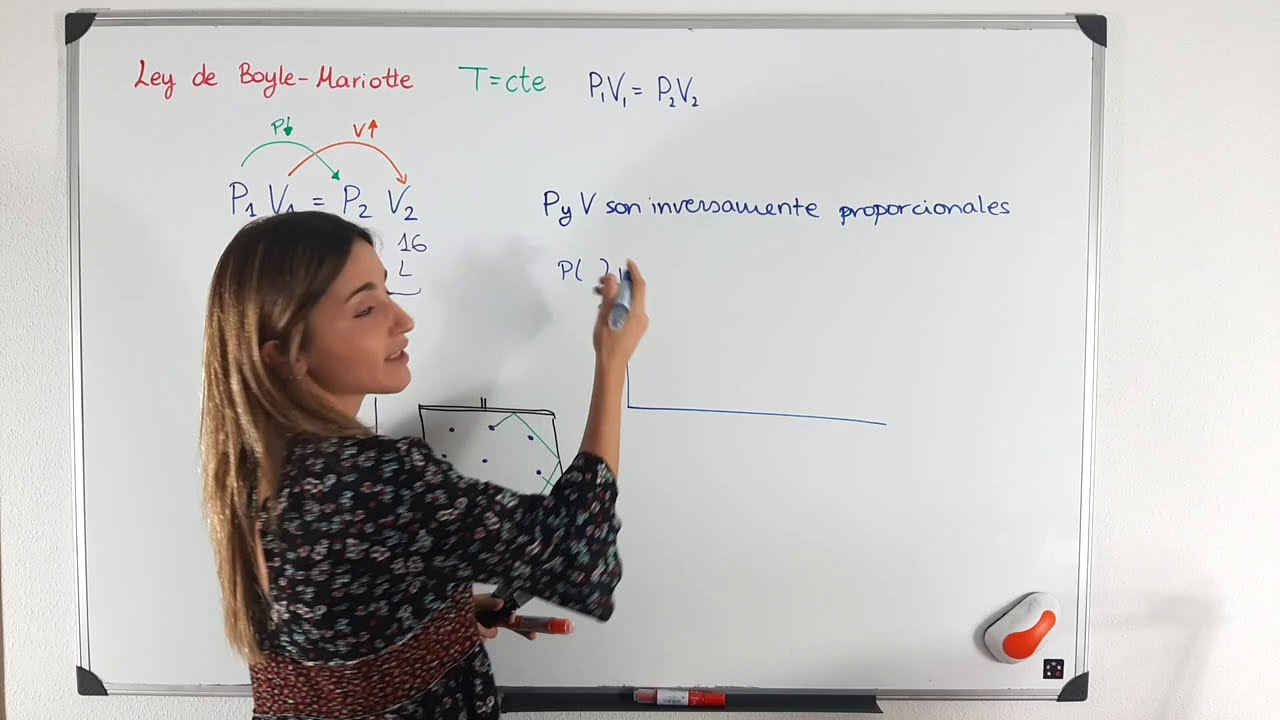
¿Qué es la Ley de Boyle Mariotte?
La Ley de Boyle Mariotte, también conocida como la Ley de Boyle, es una de las leyes fundamentales de la física que describe cómo cambia el volumen de un gas cuando cambia su presión. Esta ley establece una relación inversamente proporcional entre la presión y el volumen de un gas a temperatura constante: a medida que la presión aumenta, el volumen disminuye, y viceversa.
La importancia de la Ley de Boyle Mariotte en la física y la química
La Ley de Boyle Mariotte es fundamental en la física y la química, ya que proporciona una relación matemática entre la presión y el volumen de un gas. Esta ley es aplicable en una amplia variedad de fenómenos, desde el funcionamiento de los motores de combustión interna hasta la termodinámica de los gases.
La Ley de Boyle Mariotte puede utilizarse para predecir cómo se comportará un gas en diferentes condiciones de presión y volumen. Esto es esencial para entender y controlar procesos como la compresión de gases, el transporte de fluidos y la generación de energía.
¿Quién descubrió la Ley de Boyle Mariotte?
La Ley de Boyle Mariotte fue formulada por primera vez por el científico y filósofo británico Robert Boyle en el siglo XVII. Boyle realizó numerosos experimentos con gases y descubrió que cuando la presión de un gas aumenta, su volumen disminuye y viceversa. Estos descubrimientos sentaron las bases de la termodinámica y le valieron a Boyle el reconocimiento como uno de los padres de la química moderna.
La fórmula de la Ley de Boyle Mariotte
La Ley de Boyle Mariotte se puede expresar matemáticamente mediante la siguiente fórmula:
P1 * V1 = P2 * V2
donde P1 es la presión inicial, V1 es el volumen inicial, P2 es la presión final y V2 es el volumen final. Esta fórmula muestra que el producto de la presión y el volumen en cualquier estado dado de un gas es igual al producto de la presión y el volumen en cualquier otro estado del gas.
Aplicaciones prácticas de la Ley de Boyle Mariotte
La Ley de Boyle Mariotte tiene numerosas aplicaciones prácticas en diversos campos, desde la industria hasta la medicina. Algunos ejemplos de estas aplicaciones son:
Sistemas de aire acondicionado y refrigeración
La Ley de Boyle Mariotte es fundamental en el diseño y funcionamiento de sistemas de aire acondicionado y refrigeración. Esta ley permite comprender cómo el cambio de la presión de un gas puede producir enfriamiento, lo que es esencial para la refrigeración y la climatización.
Mergullo y buceo
La Ley de Boyle Mariotte también es relevante en el contexto del buceo y el mergullo. Cuando un buceador desciende a profundidades mayores, la presión aumenta y el volumen de los gases en su cuerpo se comprime. Es importante tener en cuenta esta ley para evitar la aparición de enfermedades descompresivas.
Industria química
En la industria química, la Ley de Boyle Mariotte es esencial para determinar cómo un cambio en la presión de un gas puede afectar la velocidad y la eficiencia de una reacción química. Esta ley permite optimizar los procesos químicos y garantizar resultados consistentes.
¿Cómo afecta la temperatura a la Ley de Boyle Mariotte?
Aunque la Ley de Boyle Mariotte asume una temperatura constante, la temperatura también puede influir en el comportamiento de los gases. Si la temperatura aumenta, el volumen de un gas tiende a aumentar a una presión constante, lo que se conoce como Ley de Charles.
¿Puede la Ley de Boyle Mariotte aplicarse a líquidos y sólidos?
No, la Ley de Boyle Mariotte solo se aplica a los gases. Los líquidos y los sólidos tienen propiedades diferentes y no siguen la misma relación entre presión y volumen.
¿Dónde puedo encontrar ejemplos adicionales de la Ley de Boyle Mariotte en la vida cotidiana?
La Ley de Boyle Mariotte se puede observar en numerosos ejemplos en la vida cotidiana, como el inflado de neumáticos, la carbonatación de bebidas gaseosas y la utilización de aerosoles. También se puede aplicar al estudio de los pulmones humanos y la ventilación mecánica en los hospitales.
En resumen, la Ley de Boyle Mariotte es una ley fundamental en la física y la química que describe cómo cambia el volumen de un gas cuando cambia su presión. Esta ley, formulada por Robert Boyle, se aplica en diversos campos y tiene numerosas aplicaciones prácticas. La comprensión de la Ley de Boyle Mariotte es esencial para entender y controlar el comportamiento de los gases en diferentes condiciones.