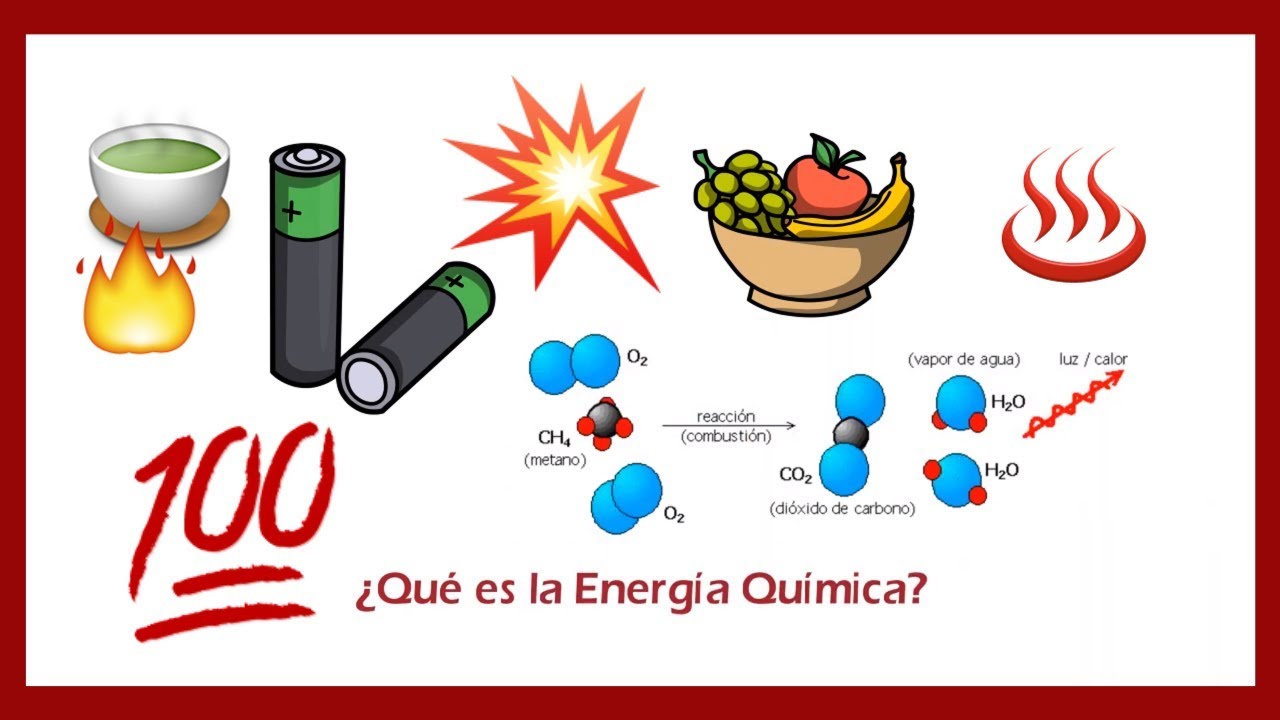
¿Qué es la energía de las reacciones químicas?
La energía de las reacciones químicas es un fenómeno que ocurre cuando se produce una transformación en las sustancias químicas. En estas reacciones, los enlaces entre los átomos de las moléculas se rompen y se vuelven a formar, lo que provoca un cambio en la energía del sistema. Este proceso puede liberar energía en forma de calor, luz o electricidad, o absorber energía del entorno.
Tipos de reacciones químicas y su energía asociada
Existen diferentes tipos de reacciones químicas, cada una con su propio tipo de energía asociada. Algunos ejemplos de estas reacciones incluyen las reacciones de combustión, las reacciones de descomposición y las reacciones de síntesis.
Las reacciones de combustión son aquellas en las que un compuesto orgánico reacciona con oxígeno para producir dióxido de carbono y agua, liberando una gran cantidad de energía en forma de calor y luz. Estas reacciones son la base de muchos procesos industriales y también son responsables de la liberación de energía en los motores de combustión interna.
Las reacciones de descomposición son aquellas en las que un compuesto se divide en dos o más sustancias más simples. Estas reacciones pueden ser endotérmicas o exotérmicas, dependiendo de si requieren o liberan energía. Por ejemplo, la descomposición del peróxido de hidrógeno en agua y oxígeno es una reacción exotérmica, ya que libera energía en forma de calor.
Por otro lado, las reacciones de síntesis son aquellas en las que dos o más sustancias se combinan para formar un compuesto más complejo. Estas reacciones también pueden ser endotérmicas o exotérmicas, dependiendo de los cambios en la energía. Un ejemplo de una reacción de síntesis es la formación de agua a partir de hidrógeno y oxígeno, liberando una gran cantidad de energía en forma de calor.
Importancia de la energía en la vida cotidiana
La energía de las reacciones químicas es fundamental para nuestra vida cotidiana. Muchos de los procesos químicos que ocurren en nuestro cuerpo, como la digestión de los alimentos, la respiración celular y la producción de energía en las células, son el resultado de reacciones químicas que liberan energía.
Además, la mayoría de las fuentes de energía que utilizamos, como la electricidad y los combustibles fósiles, se basan en reacciones químicas que liberan energía. El entendimiento de estas reacciones y la forma en que pueden ser controladas y aprovechadas es crucial para el desarrollo de tecnologías más eficientes y sostenibles.
Factores que afectan la energía de las reacciones químicas
La energía de las reacciones químicas puede verse influenciada por varios factores, entre ellos:
1. Concentración de los reactivos: A medida que aumenta la concentración de los reactivos, la energía de la reacción también tiende a aumentar.
2. Temperatura: Un aumento en la temperatura generalmente aumenta la velocidad de la reacción y, por lo tanto, la energía liberada o absorbida.
3. Presión: En el caso de reacciones gaseosas, un aumento en la presión puede aumentar la energía de la reacción.
4. Catalizadores: Los catalizadores son sustancias que aceleran la velocidad de una reacción química sin ser consumidos en el proceso. Estos pueden reducir la energía de activación necesaria para que ocurra la reacción.
Es importante tener en cuenta estos factores al diseñar y controlar procesos químicos, ya que pueden tener un impacto significativo en la eficiencia y el rendimiento de las reacciones.
Aplicaciones de la energía de las reacciones químicas
La energía de las reacciones químicas tiene una amplia variedad de aplicaciones en diferentes industrias y campos de estudio. Algunas de estas aplicaciones incluyen:
1. Producción de energía eléctrica: Las centrales eléctricas utilizan reacciones químicas, como la combustión de combustibles fósiles o la fisión nuclear, para generar electricidad.
2. Industria farmacéutica: La síntesis de medicamentos y productos farmacéuticos implica reacciones químicas que pueden ser controladas para garantizar la eficacia y seguridad de los productos.
3. Tecnología de baterías: Las baterías recargables utilizan reacciones químicas para almacenar y liberar energía eléctrica de manera eficiente.
4. Procesos industriales: Muchos procesos de fabricación, como la producción de plásticos, fertilizantes, alimentos y textiles, dependen de reacciones químicas para llevarse a cabo.
5. Energías renovables: Las reacciones químicas también desempeñan un papel importante en la generación de energías renovables, como la producción de biocombustibles a partir de biomasa y la conversión de la luz solar en energía eléctrica en celdas solares.
Estas son solo algunas de las muchas aplicaciones de la energía de las reacciones químicas en nuestra vida diaria. La comprensión de estos procesos y su manejo adecuado puede contribuir al desarrollo de tecnologías más eficientes y sostenibles.
¿Qué es la energía de activación en una reacción química?
La energía de activación es la energía mínima que necesita una reacción química para iniciar. Es la barrera energética que debe superarse para que los reactivos se conviertan en productos. Una vez superada esta barrera, la reacción puede continuar y liberar la energía asociada.
¿Cómo se mide la energía de una reacción química?
La energía de una reacción química se mide mediante la variación de entalpía, que es la diferencia entre las energías de los productos y los reactivos. Esta diferencia de energía se puede determinar experimentalmente utilizando calorímetros u otras técnicas de medición de calor.
¿Qué es una reacción endotérmica y una reacción exotérmica?
Una reacción endotérmica es aquella que absorbe energía del entorno, lo que resulta en un aumento de la energía del sistema. Por otro lado, una reacción exotérmica es aquella que libera energía al entorno, lo que resulta en una disminución de la energía del sistema.
¿Cómo se puede controlar la energía de una reacción química?
La energía de una reacción química puede ser controlada a través de varios factores, como la temperatura, la presión y la concentración de los reactivos. La adición de catalizadores también puede reducir la energía de activación necesaria para la reacción. Estas variables pueden ser ajustadas para obtener el resultado deseado en términos de energía liberada o absorbida.