¿Qué es un átomo y por qué es importante?
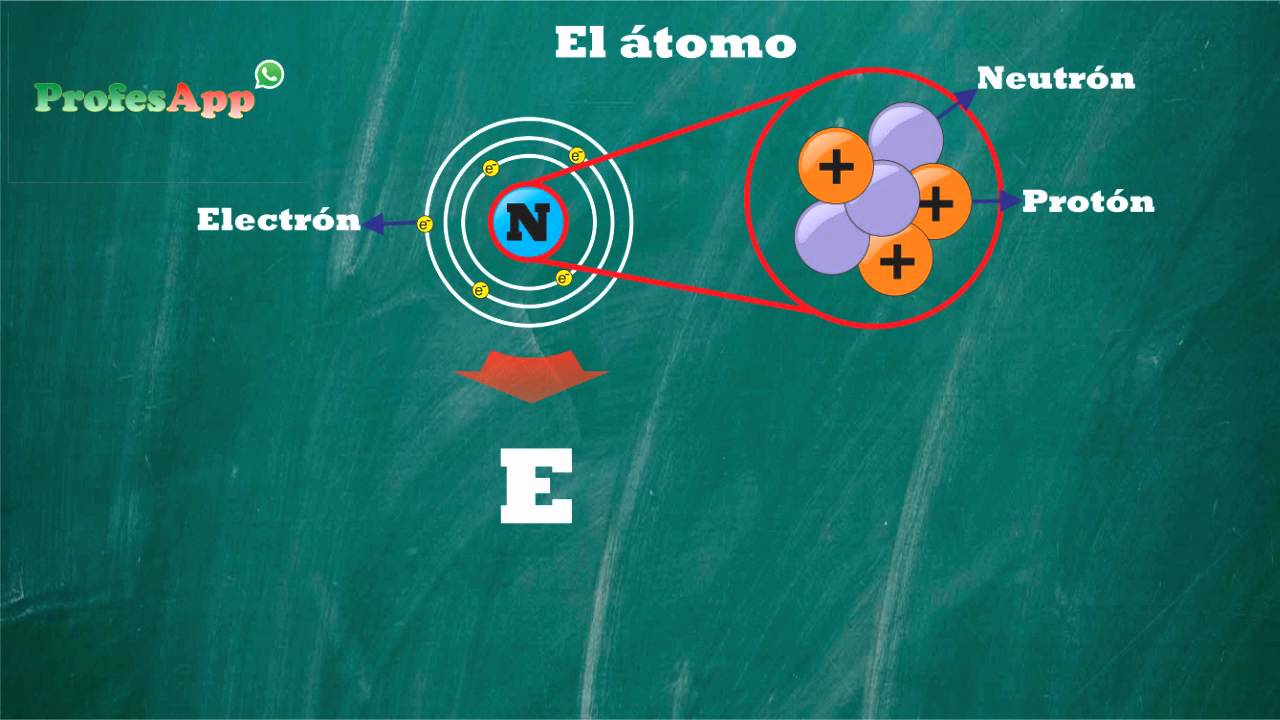
El átomo es una de las unidades fundamentales de la materia. Es la unidad más pequeña de un elemento químico que mantiene su identidad y propiedades químicas. Los átomos están compuestos por un núcleo, que contiene protones y neutrones, y una nube de electrones que orbitan alrededor del núcleo. La comprensión de la estructura atómica es esencial para entender cómo funcionan y se combinan los elementos en el universo.
Desde los primeros intentos filosóficos de definir la estructura atómica hasta los avances científicos más recientes, la investigación en este campo ha revolucionado nuestro conocimiento y ha tenido un impacto significativo en muchos aspectos de nuestras vidas. En este artículo, exploraremos todo lo que debes saber sobre el átomo y su composición de una manera accesible y fácil de entender.
¿Cómo se descubrió la estructura atómica?
El descubrimiento de la estructura atómica ha sido un proceso largo y fascinante que involucra a muchos científicos destacados en diferentes momentos de la historia. Uno de los primeros modelos propuestos fue el modelo de Dalton, quien postuló que los átomos eran esferas indivisibles y que diferentes elementos estaban compuestos por átomos de diferentes masas. Sin embargo, estudios posteriores revelaron que los átomos no eran indivisibles y que contenían partículas subatómicas.
Uno de los principales avances en la comprensión de la estructura atómica fue el descubrimiento del electrón por J.J. Thomson. Utilizando experimentos con tubos de rayos catódicos, Thomson demostró que los átomos contenían partículas con carga negativa que eran mucho más pequeñas que los propios átomos. Esto llevó al desarrollo del modelo del pastel de pasas, en el que los electrones se encontraban incrustados en un átomo positivamente cargado.
Sin embargo, el modelo del pastel de pasas fue posteriormente reemplazado por el modelo nuclear de Rutherford. A través de su famoso experimento de la lámina de oro, Rutherford descubrió que la mayor parte de la masa de un átomo estaba concentrada en un núcleo pequeño y denso, con electrones orbitando a su alrededor en órbitas definidas. Este descubrimiento fue revolucionario y sentó las bases para la comprensión moderna de los átomos.
Desde entonces, la ciencia ha avanzado aún más en el estudio de la estructura atómica, con la introducción de modelos cuánticos y la comprensión de partículas subatómicas como quarks y leptones. Hoy en día, continuamos descubriendo más sobre la estructura atómica y su papel en el universo.
La composición de un átomo: protones, neutrones y electrones
El átomo está compuesto por tres partículas fundamentales: protones, neutrones y electrones.
Los protones tienen carga positiva y se encuentran en el núcleo del átomo. Son responsables de mantener la identidad de un elemento, ya que el número de protones en un átomo determina su número atómico. Por ejemplo, un átomo de hidrógeno tiene un protón, mientras que un átomo de carbono tiene seis protones.
Los neutrones, por otro lado, son partículas neutras que también se encuentran en el núcleo del átomo. Su función principal es estabilizar el núcleo mediante la interacción fuerte con los protones. El número de neutrones en un átomo puede variar, lo que da lugar a isótopos diferentes del mismo elemento. Por ejemplo, el carbono-12 y el carbono-14 son isótopos del carbono con diferente número de neutrones.
Finalmente, los electrones son partículas con carga negativa que orbitan alrededor del núcleo en diferentes niveles de energía. La cantidad de electrones en un átomo es igual al número de protones, ya que los átomos son eléctricamente neutros. Sin embargo, los electrones pueden interactuar entre sí y con el ambiente, lo que resulta en cambios en la energía y la estabilidad del átomo.
Juntos, los protones, neutrones y electrones forman la estructura básica de los átomos y son responsables de las propiedades químicas y físicas de los elementos.
¿Cómo se organizan los electrones en un átomo?
La organización de los electrones en un átomo está determinada por su nivel de energía y su relación con el núcleo. Los niveles de energía se dividen en capas, cada una de las cuales puede contener un número máximo de electrones.
La capa más cercana al núcleo se llama capa K y puede contener hasta dos electrones. La segunda capa, llamada capa L, puede contener hasta ocho electrones. A medida que se agregan más electrones, se llenan capas adicionales en un orden específico hasta alcanzar la capa más externa, conocida como capa de valencia.
La capa de valencia es la más importante desde el punto de vista químico, ya que los electrones en esta capa determinan cómo interactúa un átomo con otros átomos. Los electrones en la capa de valencia pueden ser compartidos, transferidos o atraídos por otros átomos, lo que da lugar a enlaces químicos y la formación de compuestos.
La configuración electrónica de un átomo se puede representar utilizando números y letras que indican el número de electrones en cada nivel de energía. Por ejemplo, la configuración electrónica del carbono es 1s2 2s2 2p2.
Comprender la organización de los electrones en un átomo nos ayuda a explicar las propiedades y comportamientos de los elementos en la tabla periódica y a predecir sus reacciones químicas.
La importancia de la estructura atómica
La comprensión de la estructura atómica es esencial en muchas disciplinas científicas y tecnológicas. Aquí hay algunas razones por las que la estructura atómica es importante:
La química y la reactividad de los elementos
La estructura atómica determina cómo los elementos interactúan entre sí y cómo se forman los compuestos químicos. Los electrones en la capa de valencia son especialmente importantes en las reacciones químicas, ya que son los que participan en el intercambio y la transferencia de electrones entre átomos.
Comprender la estructura atómica nos permite predecir cómo se comportarán los elementos y los compuestos en diferentes entornos, lo que es fundamental para la industria química, la farmacología y muchas otras aplicaciones.
La física de los materiales
La estructura atómica también tiene un gran impacto en las propiedades físicas de los materiales. Por ejemplo, la disposición de los átomos y los enlaces entre ellos determinan la dureza, la conductividad eléctrica y térmica, y muchas otras características de los materiales.
La ingeniería de materiales y la nanotecnología se basan en la manipulación y comprensión de la estructura atómica para crear materiales con propiedades específicas.
La energía y la tecnología nuclear
La energía nuclear se basa en la manipulación y liberación de la energía contenida en los núcleos atómicos. La comprensión de la estructura atómica es fundamental para el desarrollo y la operación segura de centrales nucleares, así como para la investigación en la fusión nuclear y en la tecnología de materiales nucleares.
La astrofísica y la cosmología
El estudio de la estructura atómica también es esencial para comprender los procesos que ocurren en el universo. Por ejemplo, el estudio de los átomos y las partículas subatómicas nos permite comprender el origen de los elementos en la nucleosíntesis estelar y cómo se forman las estrellas y las galaxias.
La estructura atómica es una parte fundamental de nuestra comprensión del mundo que nos rodea, desde la química hasta la física y la astrofísica. Continuamos explorando y descubriendo más sobre la estructura atómica, lo que nos permite avanzar en muchas áreas de la ciencia y la tecnología.
¿Cuál es el tamaño de un átomo?
El tamaño de un átomo puede variar según el elemento. Sin embargo, en general, los átomos tienen diámetros en el rango de 0.1 a 0.5 nanómetros.
¿Cómo se determina la estructura atómica?
La estructura atómica se determina mediante técnicas como la espectroscopia, la difracción de rayos X y la microscopía de alta resolución.
¿Cuántos elementos diferentes existen en la naturaleza?
En la actualidad, se han descubierto y caracterizado alrededor de 118 elementos. Estos elementos componen toda la materia visible en el universo.
¿Cuál es el átomo más grande?
El átomo más grande conocido hasta ahora es el de francio, que tiene 87 protones y electrones en su estado fundamental.
¿Cuál es el átomo más pequeño?
El átomo más pequeño conocido es el de helio, que tiene solo dos protones y electrones en su estado fundamental.
Esperamos que este artículo te haya proporcionado una comprensión más profunda de la fascinante estructura atómica y su importancia en diferentes campos de la ciencia y la tecnología. ¡Sigue explorando y disfrutando del mundo de los átomos!