El átomo de hidrógeno es uno de los sistemas más simples y fundamentales en la física cuántica. Su comportamiento es descrito por la ecuación de Schrödinger, una fórmula matemática que nos permite comprender la estructura y las propiedades de este átomo. En este artículo, te proporcionaremos una explicación paso a paso de la ecuación de Schrödinger para el átomo de hidrógeno, así como sus fórmulas y aplicaciones.
¿Qué es la ecuación de Schrödinger y por qué es importante?
La ecuación de Schrödinger es una ecuación fundamental de la física cuántica que describe el comportamiento de partículas subatómicas, como electrones, en un sistema dado. Fue desarrollada por Erwin Schrödinger en 1925 y es uno de los pilares de la mecánica cuántica.
La importancia de la ecuación de Schrödinger radica en que nos permite determinar las funciones de onda de las partículas, es decir, las distribuciones de probabilidad de encontrar una partícula en una posición y momento dados. Además, nos proporciona información sobre las energías permitidas en un sistema cuántico y las transiciones entre estados energéticos.
Explicación paso a paso de la ecuación de Schrödinger para el átomo de hidrógeno
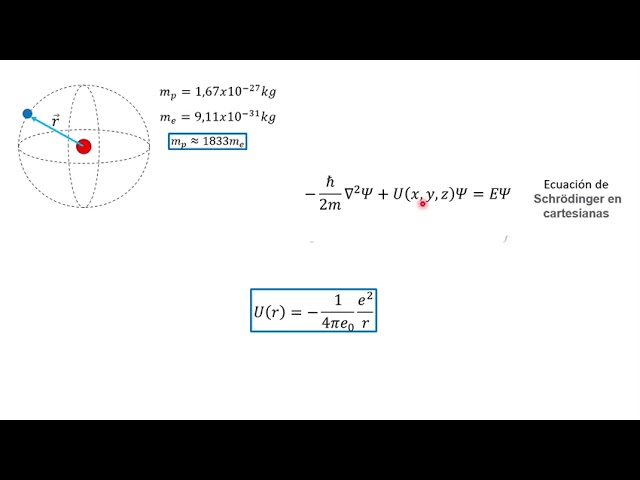
Para entender la ecuación de Schrödinger para el átomo de hidrógeno, debemos considerar algunos conceptos fundamentales de la física cuántica. El átomo de hidrógeno consta de un núcleo con carga positiva, el protón, y un electrón con carga negativa orbitando alrededor del núcleo.
El Hamiltoniano del sistema
El primer paso en la derivación de la ecuación de Schrödinger es escribir el Hamiltoniano del sistema. El Hamiltoniano es el operador que representa la energía total del sistema. En el caso del átomo de hidrógeno, el Hamiltoniano incluye las energías cinética y potencial del electrón y la interacción electrostática entre el electrón y el núcleo.
La expresión matemática del Hamiltoniano del átomo de hidrógeno es:

Donde m es la masa del electrón, e es la carga del electrón, r es la distancia entre el electrón y el núcleo, y V es el potencial electrostático entre el electrón y el núcleo.