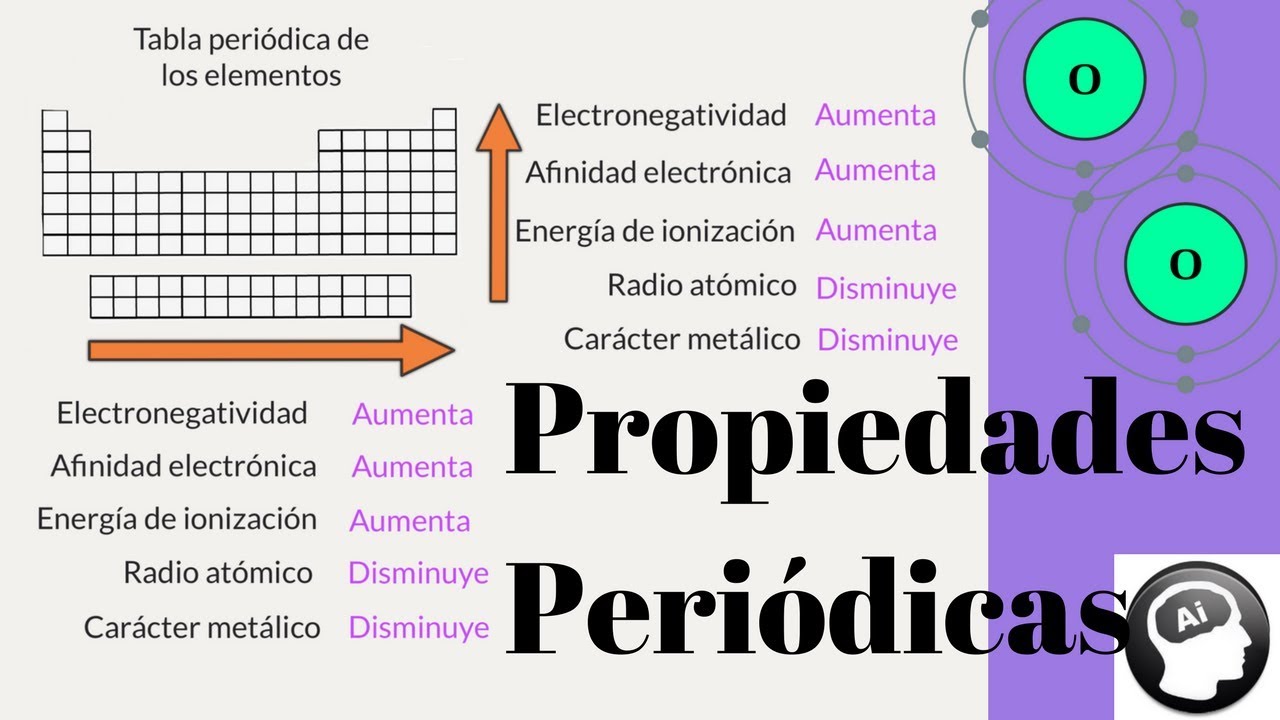
¿Qué son las Propiedades Periódicas de los Elementos?
Las propiedades periódicas de los elementos son características físicas y químicas que se repiten de manera regular en la tabla periódica. Estas propiedades nos permiten entender cómo los elementos están organizados y cómo se relacionan entre sí. En este artículo, exploraremos de manera detallada las propiedades periódicas más importantes y cómo afectan el comportamiento de los elementos.
El Tamaño Atómico: ¿Cómo se mide?
El tamaño atómico se refiere al tamaño de un átomo y se puede medir de diferentes formas. Una de las formas más comunes de medir el tamaño atómico es a través del radio atómico, que es la mitad de la distancia entre los núcleos de dos átomos adyacentes. En general, el tamaño atómico tiende a aumentar a medida que nos movemos hacia abajo en un grupo de la tabla periódica y disminuye a medida que nos movemos de izquierda a derecha en un período.
La Electronegatividad: La atracción por los electrones
La electronegatividad es la capacidad de un átomo para atraer electrones en un enlace químico. Se mide utilizando la Escala de Electronegatividad de Pauling, donde los elementos más electronegativos se encuentran en la parte superior derecha de la tabla periódica. La electronegatividad también varía en función de la posición del elemento en la tabla, aumentando a medida que nos movemos hacia arriba y hacia la derecha.
La Energía de Ionización: La fuerza para arrancar electrones
La energía de ionización es la energía requerida para arrancar un electrón de un átomo gaseoso. En general, la energía de ionización disminuye a medida que nos movemos hacia abajo en un grupo de la tabla periódica y aumenta a medida que nos movemos de izquierda a derecha en un período. Esto se debe a que los electrones están más alejados del núcleo y son menos atraídos por él en los átomos más grandes, lo que facilita su remoción.
La Afinidad Electrónica: La tendencia a ganar electrones
La afinidad electrónica es la energía liberada cuando un átomo gana un electrón para formar un ion negativo. Al igual que la energía de ionización, la afinidad electrónica suele disminuir hacia abajo en un grupo y aumentar de izquierda a derecha en un período. Esto se debe a que los átomos de mayor tamaño tienen una mayor capacidad para aceptar electrones adicionales.
La Reactividad Química: La tendencia a participar en reacciones
La reactividad química se refiere a la facilidad con la que un elemento puede participar en una reacción química. La reactividad varía de un elemento a otro y depende de su estructura electrónica y sus propiedades periódicas. Por ejemplo, los metales alcalinos son altamente reactivos debido a su baja energía de ionización, mientras que los gases nobles son menos reactivos debido a su alta energía de ionización.
La Valencia: La capacidad de un átomo para formar enlaces
La valencia se refiere a la capacidad de un átomo para formar enlaces químicos con otros átomos. La valencia de un elemento está determinada por el número de electrones en su capa de valencia, que es la capa más externa de electrones. Los elementos con una valencia alta tienden a ser más reactivos, ya que buscan ganar o perder electrones para alcanzar una configuración electrónica estable.
La Conductividad Eléctrica: La facilidad para conducir electricidad
La conductividad eléctrica se refiere a la capacidad de un material para conducir electricidad. En general, los metales son buenos conductores de electricidad debido a la presencia de electrones libres en su estructura cristalina. Por otro lado, los no metales suelen ser malos conductores de electricidad, ya que los electrones están fuertemente ligados a los átomos y no pueden moverse con facilidad.
¿Por qué son importantes las Propiedades Periódicas?
Las propiedades periódicas de los elementos son esenciales para comprender y predecir su comportamiento químico. Estas propiedades nos permiten entender cómo se relacionan los elementos entre sí, así como sus capacidades para formar enlaces y participar en reacciones. Además, el estudio de las propiedades periódicas es fundamental en la química y la ciencia de los materiales, ya que nos ayuda a diseñar nuevas sustancias y compuestos con propiedades específicas.
FAQ: Preguntas Frecuentes
1. ¿Por qué el tamaño atómico aumenta hacia abajo en un grupo?
2. ¿Cómo afecta la electronegatividad a la polaridad de los enlaces químicos?
3. ¿Cuál es la relación entre la energía de ionización y la reactividad química?
4. ¿Por qué los no metales son malos conductores de electricidad?
5. ¿Cómo se determina la valencia de un elemento en la tabla periódica?
6. ¿Cómo afectan las propiedades periódicas a la formación de enlaces iónicos y covalentes?