¿Qué es la configuración electrónica?
La configuración electrónica es la distribución y organización de los electrones en los átomos de los elementos químicos. Es un aspecto fundamental para comprender cómo interactúan los átomos y cómo se forman los enlaces químicos.
La importancia de la configuración electrónica
Dentro de un átomo, los electrones ocupan diferentes niveles de energía, conocidos como capas o niveles electrónicos. Cada nivel tiene una capacidad máxima de electrones. La distribución específica de estos electrones en los diferentes niveles determina las propiedades químicas y el comportamiento del elemento.
¿Cómo se escribe la configuración electrónica?
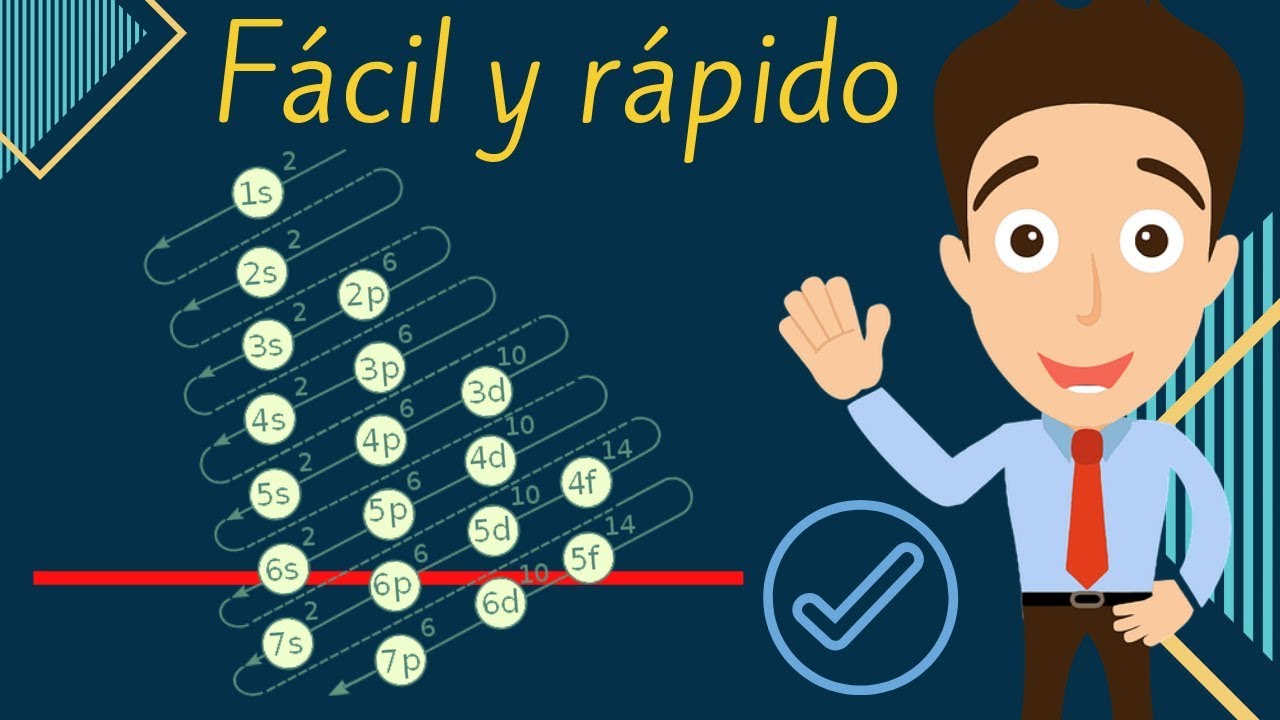
La configuración electrónica se escribe utilizando números y letras para representar cada nivel y subnivel de energía. Cada nivel se representa por un número, mientras que cada subnivel se representa por una letra, como s, p, d o f.
Niveles de energía y subniveles
Los niveles de energía en un átomo se denominan con números, comenzando desde 1 hasta el número máximo de niveles permitidos para ese elemento en particular. El primer nivel, con menor energía, se representa por el número 1, el segundo nivel por el número 2, y así sucesivamente.
Los subniveles se representan con letras: s, p, d o f. Cada subnivel tiene una capacidad de electrones específica. El subnivel s puede contener hasta 2 electrones, el subnivel p hasta 6 electrones, el subnivel d hasta 10 electrones y el subnivel f hasta 14 electrones.
Ejemplos de configuración electrónica
Ahora veamos algunos ejemplos de configuración electrónica para entender mejor cómo se escribe:
– El hidrógeno, con número atómico 1, tiene una configuración electrónica de 1s1. Esto significa que tiene 1 electrón en el nivel 1, subnivel s.
– El sodio, con número atómico 11, tiene una configuración electrónica de 1s2 2s2 2p6 3s1. Esto representa que tiene 2 electrones en el nivel 1, subnivel s; 2 electrones en el nivel 2, subnivel s; 6 electrones en el nivel 2, subnivel p; y 1 electrón en el nivel 3, subnivel s.
¿Cómo determinar la configuración electrónica?
Ahora que hemos aprendido cómo se escribe la configuración electrónica, es importante saber cómo determinarla para cualquier elemento.
La configuración electrónica se determina siguiendo un orden específico conocido como la regla del aufbau. Esta regla establece que los electrones se añaden en orden ascendente de acuerdo a su energía, desde los niveles más bajos hasta los niveles más altos.
Además, se debe tener en cuenta el principio de exclusión de Pauli, que establece que un nivel o subnivel solo puede contener un máximo de dos electrones con espines opuestos.
Para determinar la configuración electrónica, se puede utilizar la tabla periódica como guía. La tabla periódica muestra el orden de los elementos y la secuencia en la que se agregan los electrones a los diferentes niveles y subniveles.
Configuración electrónica y propiedades químicas
La configuración electrónica tiene un impacto directo en las propiedades químicas de los elementos. Determina la capacidad de un átomo para formar enlaces químicos, su reactividad y su tendencia a ganar o perder electrones.
Por ejemplo, los elementos con configuraciones electrónicas completas en sus niveles más altos son estables y tienden a no formar enlaces químicos con otros elementos.
¿Cuál es la configuración electrónica del átomo de oxígeno?
El átomo de oxígeno tiene número atómico 8. Según su configuración electrónica, su distribución es 1s2 2s2 2p4. Esto significa que tiene 2 electrones en el nivel 1, subnivel s; 2 electrones en el nivel 2, subnivel s; y 4 electrones en el nivel 2, subnivel p.
La configuración electrónica del oxígeno indica que tiene 6 electrones en su capa de valencia, lo que explica su tendencia a ganar 2 electrones para alcanzar una configuración similar a la del gas noble más cercano, el neón.
Configuración electrónica en la tabla periódica
La configuración electrónica puede proporcionar información valiosa sobre la posición de los elementos en la tabla periódica. A medida que avanzamos en la tabla periódica de izquierda a derecha y de arriba a abajo, la configuración electrónica sigue un patrón bien definido.
…
…
…
…
…
…
1. ¿Qué es un nivel de energía en un átomo?
Los niveles de energía en un átomo son las capas o anillos alrededor del núcleo donde los electrones se distribuyen.
2. ¿Cómo se determina la configuración electrónica de un elemento?
La configuración electrónica se determina siguiendo la regla del aufbau y utilizando la tabla periódica como guía.
3. ¿Qué papel juega la configuración electrónica en las propiedades químicas de los elementos?
La configuración electrónica determina la reactividad, capacidad de formar enlaces y otras propiedades químicas de los elementos.
4. ¿Por qué es importante conocer la configuración electrónica de los elementos?
Conocer la configuración electrónica de los elementos es fundamental para comprender el comportamiento químico y la relación entre los diferentes elementos en la tabla periódica.
5. ¿Cuál es la configuración electrónica del carbono?
El carbono tiene número atómico 6 y su configuración electrónica es 1s2 2s2 2p2. Esto significa que tiene 2 electrones en el nivel 1, subnivel s; 2 electrones en el nivel 2, subnivel s; y 2 electrones en el nivel 2, subnivel p.
6. ¿Cuál es la importancia de la configuración electrónica en la formación de enlaces químicos?
La configuración electrónica determina la disposición de los electrones en un átomo y, por lo tanto, su capacidad para interactuar y formar enlaces químicos con otros átomos.
7. ¿Por qué se utiliza la regla del aufbau para determinar la configuración electrónica?
La regla del aufbau es utilizada para determinar la configuración electrónica porque sigue un orden lógico y establece cómo los electrones se agregan a los diferentes niveles y subniveles de energía.
8. ¿Cuál es la configuración electrónica del sodio?
El sodio tiene número atómico 11 y su configuración electrónica es 1s2 2s2 2p6 3s1. Esto significa que tiene 2 electrones en el nivel 1, subnivel s; 2 electrones en el nivel 2, subnivel s; 6 electrones en el nivel 2, subnivel p; y 1 electrón en el nivel 3, subnivel s.
9. ¿Cómo se representan los subniveles de energía en la configuración electrónica?
Los subniveles de energía se representan con letras: s, p, d o f. Cada subnivel tiene una capacidad máxima de electrones.
10. ¿Cuál es la configuración electrónica del helio?
El helio tiene número atómico 2 y su configuración electrónica es 1s2. Esto significa que tiene 2 electrones en el nivel 1, subnivel s.