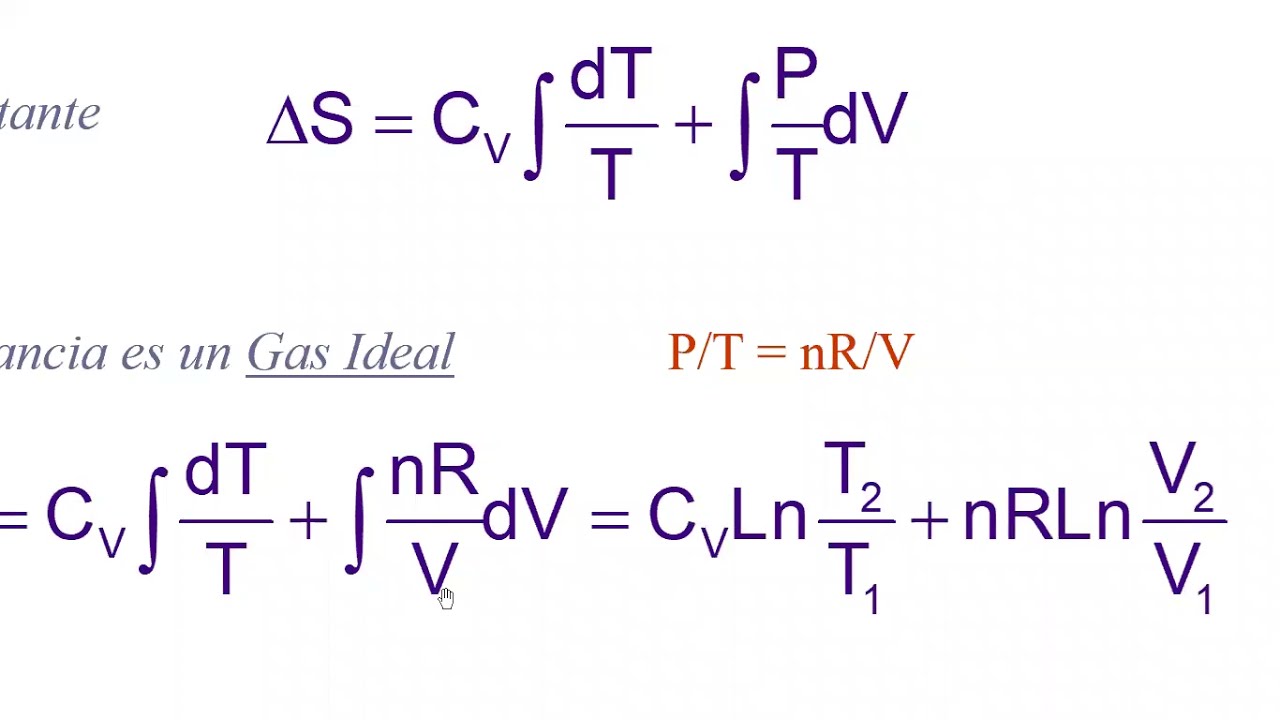Bienvenido a esta guía completa paso a paso sobre cómo calcular el cambio de entropía. En este artículo, aprenderás todo lo que necesitas saber sobre este concepto fundamental en la termodinámica. La entropía es una medida de la cantidad de desorden o caos en un sistema. Calcular su cambio es crucial para entender cómo se producen los procesos físicos y químicos. Sigue leyendo para descubrir cómo dominar este cálculo de manera sencilla y efectiva.
Paso 1: Comprender la entropía
Antes de sumergirnos en los cálculos, es importante entender qué es realmente la entropía. En términos simples, la entropía es una medida del desorden molecular de un sistema. Cuanto mayor sea la entropía, mayor será el desorden. Imagina una habitación desordenada con libros y ropa por todas partes. Esa habitación tiene una alta entropía. Por otro lado, una habitación ordenada y organizada tiene una baja entropía.
En términos científicos, la entropía se define como la cantidad de energía dispersada en un sistema a una determinada temperatura. Se representa con la letra S. Cuanto mayor sea el valor de S, mayor será la dispersión de energía y, por lo tanto, mayor será el desorden.
Paso 2: Conocer la fórmula de cambio de entropía
El cambio de entropía se representa con el símbolo ΔS. Para calcularlo, se utiliza la fórmula ΔS = Sfinal – Sinicial, donde Sfinal es la entropía del sistema al final del proceso y Sinicial es la entropía del sistema al inicio del proceso.
Paso 3: Identificar el tipo de cambio de entropía
Es importante comprender que existen dos tipos de cambio de entropía: cambio de entropía en un sistema y cambio de entropía en los alrededores del sistema.
Cuando un sistema experimenta un cambio físico o químico, su entropía cambia. Por ejemplo, si un átomo se divide en dos átomos más pequeños, la entropía del sistema aumenta. Esto se debe a que hay más partículas y, por lo tanto, más desorden molecular.
Por otro lado, cuando un sistema experimenta un cambio y afecta a los alrededores, también hay un cambio de entropía en los alrededores. Por ejemplo, si añadimos energía a un sistema, como calor, los alrededores absorben esa energía y su entropía aumenta.
Paso 4: Calcular el cambio de entropía en un sistema
Para calcular el cambio de entropía en un sistema, se deben tener en cuenta varios factores. Estos incluyen el número inicial y final de partículas, el número de átomos de cada elemento químico y los estados inicial y final de las sustancias.
La fórmula general para el cambio de entropía en un sistema es ΔS = ΣnSfinal – ΣnSinicial, donde Σn es el número de moles de cada sustancia y S es la entropía molar de la sustancia.
Paso 5: Calcular el cambio de entropía en los alrededores
Cuando un sistema experimenta un cambio que afecta a los alrededores, también podemos calcular el cambio de entropía en los alrededores. La fórmula general para este cálculo es ΔSuniverso = ΔSsistema + ΔSalrededores.
Es importante tener en cuenta que el cambio de entropía en el universo siempre es mayor o igual a cero. Esto se debe a que la naturaleza tiende al aumento del desorden.
Paso 6: Ejemplos de cálculo de cambio de entropía
Para comprender mejor estos cálculos, veamos algunos ejemplos prácticos. Imagina que tenemos una reacción química donde un compuesto A se descompone en dos compuestos B y C. El cambio de entropía para esta reacción puede calcularse utilizando las entropías de cada sustancia y los coeficientes estequiométricos de la ecuación química.
Paso 7: Importancia del cambio de entropía
El cambio de entropía es fundamental en la termodinámica y la química. Nos permite comprender cómo ocurren los procesos naturales y cómo se distribuye la energía. Además, el cambio de entropía también está relacionado con la espontaneidad de un proceso. Un cambio de entropía positivo sugiere que el proceso es espontáneo y tiende a un mayor desorden.
Comprender y calcular el cambio de entropía es esencial para diseñar procesos más eficientes y sostenibles. También es una herramienta importante en la investigación y desarrollo de nuevos materiales y tecnologías.
Paso 8: Conclusiones
En esta guía paso a paso, hemos explorado cómo calcular el cambio de entropía en un sistema y en los alrededores. Hemos visto las fórmulas y los pasos necesarios para llevar a cabo estos cálculos de manera efectiva. El cambio de entropía es un concepto fundamental en la termodinámica y la química, y su comprensión nos permite comprender mejor los procesos naturales y diseñar soluciones más eficientes en diversos campos. ¡Esperamos que esta guía te haya sido útil y haya ampliado tus conocimientos sobre este tema fascinante!
¿Cómo influye la temperatura en el cambio de entropía?
La temperatura tiene una influencia directa en el cambio de entropía. A medida que la temperatura aumenta, la entropía tiende a aumentar, ya que las partículas se mueven con mayor energía y hay más desorden en el sistema.
¿Cuál es la relación entre el cambio de entropía y la espontaneidad de un proceso?
Un cambio de entropía positivo sugiere que el proceso es espontáneo y tiende a un mayor desorden. Por otro lado, un cambio de entropía negativo indica que el proceso es no espontáneo y tiende a una mayor orden o estructura.
¿Cuántos tipos de cambio de entropía existen?
Existen dos tipos de cambio de entropía: cambio de entropía en un sistema y cambio de entropía en los alrededores del sistema.
¿Por qué es importante calcular el cambio de entropía?
Calcular el cambio de entropía es fundamental para comprender cómo se producen los procesos naturales y cómo se distribuye la energía. También ayuda a diseñar procesos más eficientes y sostenibles.
¿Hay alguna fórmula general para calcular el cambio de entropía?
Sí, la fórmula general para calcular el cambio de entropía en un sistema es ΔS = ΣnSfinal – ΣnSinicial, donde Σn es el número de moles de cada sustancia y S es la entropía molar de la sustancia.