¿Qué son los cambios de estado de la materia?
Cuando hablamos de los cambios de estado de la materia, nos referimos a las transformaciones físicas que puede experimentar una sustancia, sin que su composición química se vea alterada. Estos cambios ocurren a nivel molecular, cuando las partículas que conforman la materia se reorganizan de diferentes maneras.
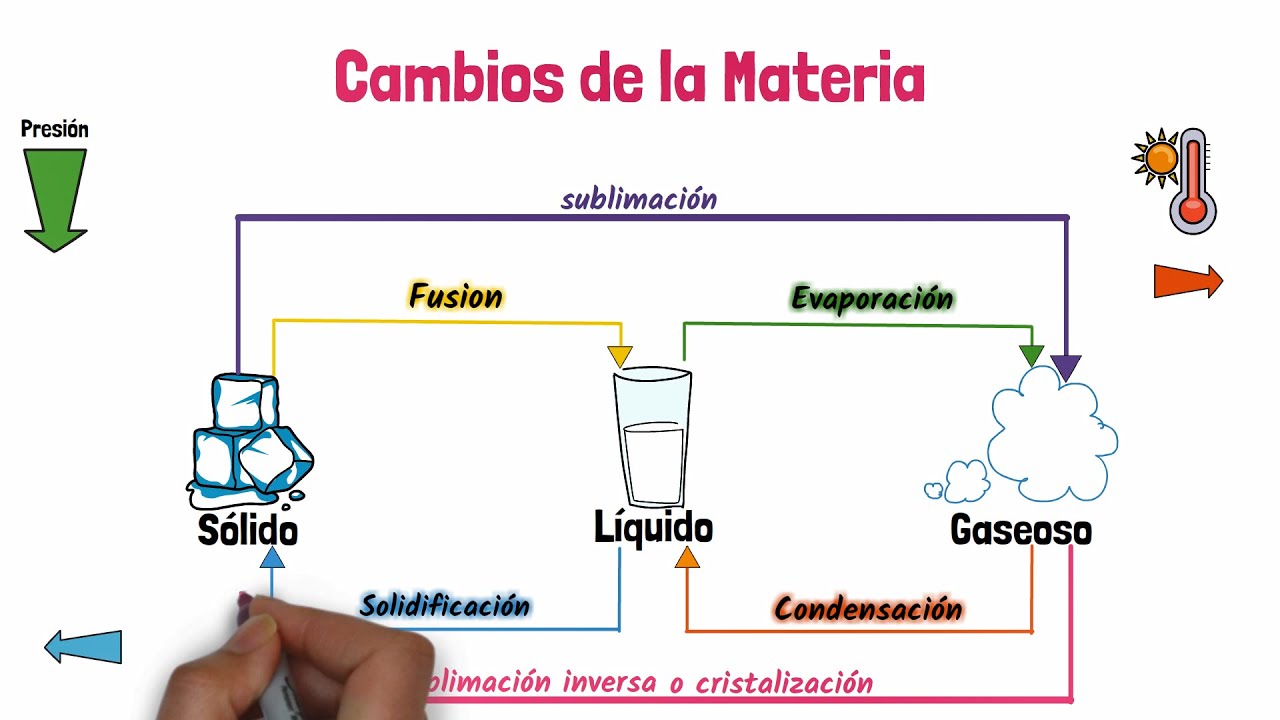
Los cambios de estado más comunes son la solidificación, la fusión, la evaporación, la condensación y la sublimación. Cada uno de estos cambios está asociado con un proceso específico y se produce a diferentes temperaturas y presiones.
¿Cuáles son los factores que influyen en los cambios de estado?
Existen diversos factores que pueden influir en los cambios de estado de la materia. Uno de los principales es la temperatura. A medida que aumenta la temperatura, las partículas de una sustancia adquieren más energía y se mueven más rápido. Esto puede llevar a que se rompan las fuerzas de atracción entre ellas y se produzca un cambio de estado.
La presión también puede tener un impacto en los cambios de estado. Por ejemplo, cuando se reduce la presión sobre un líquido, su punto de ebullición disminuye y puede evaporarse más fácilmente. Por otro lado, si se aumenta la presión sobre un gas, su punto de condensación también aumenta.
Además de la temperatura y la presión, la composición química de una sustancia y las fuerzas intermoleculares también pueden influir en los cambios de estado. Algunas sustancias, como el agua, tienen fuerzas intermoleculares más fuertes que otras, lo que hace que sus cambios de estado ocurran a temperaturas y presiones específicas.
Fases de la materia
La materia puede existir en tres fases diferentes: sólido, líquido y gas. Cada una de estas fases tiene propiedades y características distintas.
El estado sólido se caracteriza por tener una forma y un volumen definidos. Las partículas en un sólido están muy cerca unas de otras y se mantienen en posiciones fijas debido a las fuerzas de atracción intermoleculares. Algunos ejemplos de sólidos son el hielo, la madera y el metal.
Por otro lado, en el estado líquido las partículas están más separadas y pueden moverse unas respecto a otras. Los líquidos tienen un volumen definido, pero su forma puede cambiar dependiendo del recipiente que los contenga. El agua, el aceite y el alcohol son ejemplos comunes de líquidos.
Finalmente, en el estado gaseoso las partículas están mucho más separadas y se mueven libremente en todas las direcciones. Los gases no tienen una forma ni un volumen definidos, ya que se expanden para ocupar todo el espacio disponible. El oxígeno, el helio y el dióxido de carbono son ejemplos de gases.
Procesos de cambio de estado
Solidificación:
La solidificación es el proceso por el cual una sustancia pasa del estado líquido al estado sólido. Ocurre cuando se reduce la temperatura de un líquido por debajo de su punto de congelación. Durante la solidificación, las partículas se juntan, formando una estructura ordenada y estable. Un ejemplo común de solidificación es el congelamiento del agua para formar hielo.
Fusión:
La fusión es el proceso contrario a la solidificación, donde una sustancia pasa del estado sólido al estado líquido. Se produce cuando se aumenta la temperatura de un sólido por encima de su punto de fusión. Durante la fusión, las partículas adquieren suficiente energía para superar las fuerzas de atracción y comenzar a moverse más libremente. Un ejemplo de fusión es cuando calentamos chocolate sólido y se derrite en una masa líquida.
Evaporación:
La evaporación es el cambio de estado de líquido a gas, que ocurre a temperaturas inferiores a su punto de ebullición. Durante la evaporación, las partículas más energéticas en la superficie del líquido escapan y se convierten en gas. Un ejemplo cotidiano de evaporación es cuando el agua se evapora al hervir.
Condensación:
La condensación es el proceso opuesto a la evaporación, donde el vapor se convierte en líquido. Se produce cuando el vapor se enfría lo suficiente como para perder energía y agruparse formando gotas de líquido. La condensación es responsable de la formación de nubes en la atmósfera, así como del rocío en las mañanas frías.
Sublimación:
La sublimación es un cambio de estado directo de sólido a gas, sin pasar por la fase líquida intermedia. Esto ocurre cuando una sustancia sólida se calienta y alcanza su punto de sublimación, donde las partículas pasan directamente al estado gaseoso. Un ejemplo común de sublimación es cuando el hielo seco (dióxido de carbono sólido) se evapora sin dejar residuos líquidos.
¿Cuál es el punto de fusión del agua?
El punto de fusión del agua, es decir, la temperatura a la cual el agua pasa de sólido a líquido, es de 0 grados Celsius.
¿Cuál es el punto de ebullición del agua?
El punto de ebullición del agua, es decir, la temperatura a la cual el agua pasa de líquido a gas, es de 100 grados Celsius al nivel del mar.
¿Qué es la sublimación inversa?
La sublimación inversa es el proceso por el cual una sustancia pasa directamente del estado gaseoso al estado sólido, sin pasar por la fase líquida intermedia. Esto ocurre cuando se enfría un gas y se alcanza su punto de sublimación inversa. Un ejemplo de sublimación inversa es cuando el vapor de agua se congela directamente en hielo seco.
A lo largo de este artículo, hemos explorado los distintos cambios de estado que puede experimentar la materia, así como los factores que influyen en ellos. Desde la solidificación hasta la sublimación, cada cambio tiene su propio proceso y condiciones específicas. Esperamos que esta información haya sido útil para comprender mejor estos fenómenos y su importancia en el nivel 2 de educación secundaria.