¿Qué es la teoría de Brönsted-Lowry sobre los ácidos y bases?
La teoría de Brönsted-Lowry es una de las teorías fundamentales en el estudio de la química que nos ayuda a comprender la naturaleza de los ácidos y bases. Según esta teoría, un ácido es una sustancia capaz de donar un protón (un ion de hidrógeno) y una base es una sustancia capaz de aceptar un protón.
¿Cómo funciona la definición de ácido y base según la teoría de Brönsted-Lowry?
Para entender mejor la definición de ácido y base según la teoría de Brönsted-Lowry, es importante tener claras algunas ideas clave. Primero, debemos comprender qué es un protón. Un protón es una partícula subatómica con carga positiva que se encuentra en el núcleo de un átomo de hidrógeno.
En la teoría de Brönsted-Lowry, un ácido se define como una sustancia capaz de donar un protón. Esto significa que los ácidos son sustancias que tienen protón(es) adicionales en su estructura y pueden ceder uno o más de estos protones a otras sustancias.
Por otro lado, una base, según esta teoría, es una sustancia capaz de aceptar un protón. Las bases son sustancias que tienen la capacidad de aceptar uno o más protones y formar enlaces con ellos.
¿Cómo se lleva a cabo una reacción ácido-base según la teoría de Brönsted-Lowry?
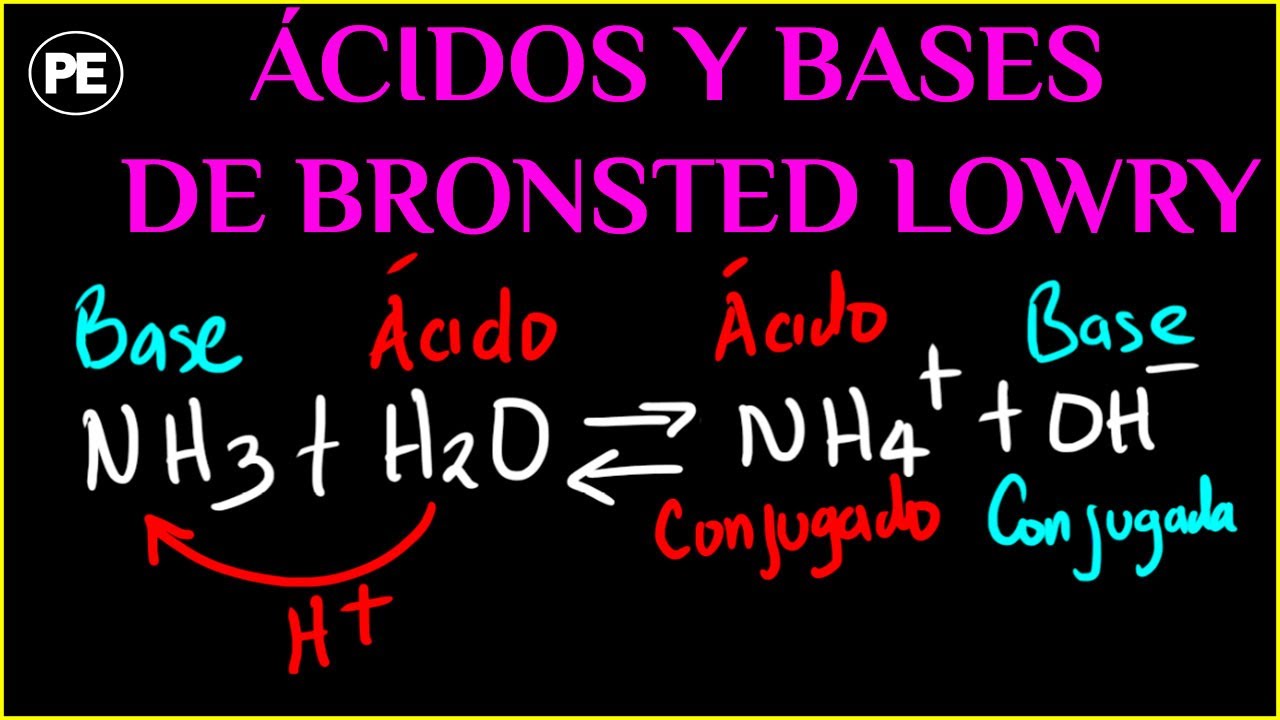
En una reacción ácido-base según la teoría de Brönsted-Lowry, un ácido dona un protón y una base acepta el protón donado. Esta reacción puede representarse de la siguiente manera:
Ácido + Base ↔ Conjugado ácido + Conjugado base
En esta reacción, el ácido dona un protón y se convierte en su conjugado ácido, mientras que la base acepta el protón y se convierte en su conjugado base. Es importante destacar que en una reacción de este tipo, los ácidos y las bases siempre actúan en pares, donde cada ácido tiene su correspondiente base conjugada y viceversa.
¿Cuáles son algunos ejemplos comunes de ácidos y bases según la teoría de Brönsted-Lowry?
Existen muchos ejemplos de ácidos y bases según la teoría de Brönsted-Lowry. Algunos ejemplos comunes de ácidos incluyen el ácido clorhídrico (HCl), el ácido sulfúrico (H2SO4) y el ácido acético (CH3COOH). Estos ácidos tienen la capacidad de donar protones.
Las bases, por otro lado, pueden ser sustancias como el hidróxido de sodio (NaOH), el hidróxido de calcio (Ca(OH)2) y el amoniaco (NH3). Estas bases tienen la capacidad de aceptar protones.
¿Cuál es la importancia de la teoría de Brönsted-Lowry?
La teoría de Brönsted-Lowry es fundamental en el estudio de la química y tiene una gran importancia en muchos aspectos de nuestra vida cotidiana. Esta teoría nos ayuda a comprender cómo ocurren las reacciones químicas ácido-base, lo que es esencial para muchos procesos biológicos y químicos.
Además, la teoría de Brönsted-Lowry nos permite clasificar y identificar sustancias como ácidos o bases, lo que es de gran utilidad en la química analítica y en la resolución de problemas relacionados con reacciones químicas.
La teoría de Brönsted-Lowry es una herramienta esencial en el estudio de los ácidos y bases. Esta teoría nos proporciona una definición clara de lo que es un ácido y una base, y nos ayuda a entender cómo se llevan a cabo las reacciones ácido-base.
Comprensión de esta teoría no solo es fundamental para los estudiantes de química, sino también para quienes se interesan por entender cómo funcionan las reacciones químicas en nuestro entorno.
¿Cuál es la diferencia entre la teoría de Brönsted-Lowry y la teoría de Arrhenius?
La teoría de Brönsted-Lowry amplía la definición de ácidos y bases más allá de la teoría de Arrhenius. Mientras que la teoría de Arrhenius define los ácidos como sustancias que liberan iones de hidrógeno en solución acuosa y las bases como sustancias que liberan iones hidróxido en solución acuosa, la teoría de Brönsted-Lowry considera los ácidos y bases en términos de transferencia de protones. Esta ampliación permite una comprensión más completa y precisa de las reacciones ácido-base.
¿Cuál es la relación entre la teoría de Brönsted-Lowry y la teoría de Lewis?
La teoría de Lewis es otra teoría importante en el estudio de las reacciones químicas. La teoría de Lewis define los ácidos como las especies que pueden aceptar pares electrónicos y las bases como las especies que pueden donar pares electrónicos. Aunque la teoría de Lewis se enfoca en la transferencia de electrones, puede considerarse complementaria a la teoría de Brönsted-Lowry, ya que ambos enfoques proporcionan una descripción más completa de las reacciones químicas.