¿Qué son las reacciones de orden 0, 1 y 2?
Cuando hablamos de reacciones químicas, es común encontrarnos con el concepto de orden. El orden de una reacción se refiere a cómo cambia la velocidad de reacción en relación con la concentración de los reactivos. En este artículo, exploraremos en detalle las reacciones de orden 0, 1 y 2, para que puedas comprender mejor cómo funcionan y cómo se aplican en diferentes contextos.
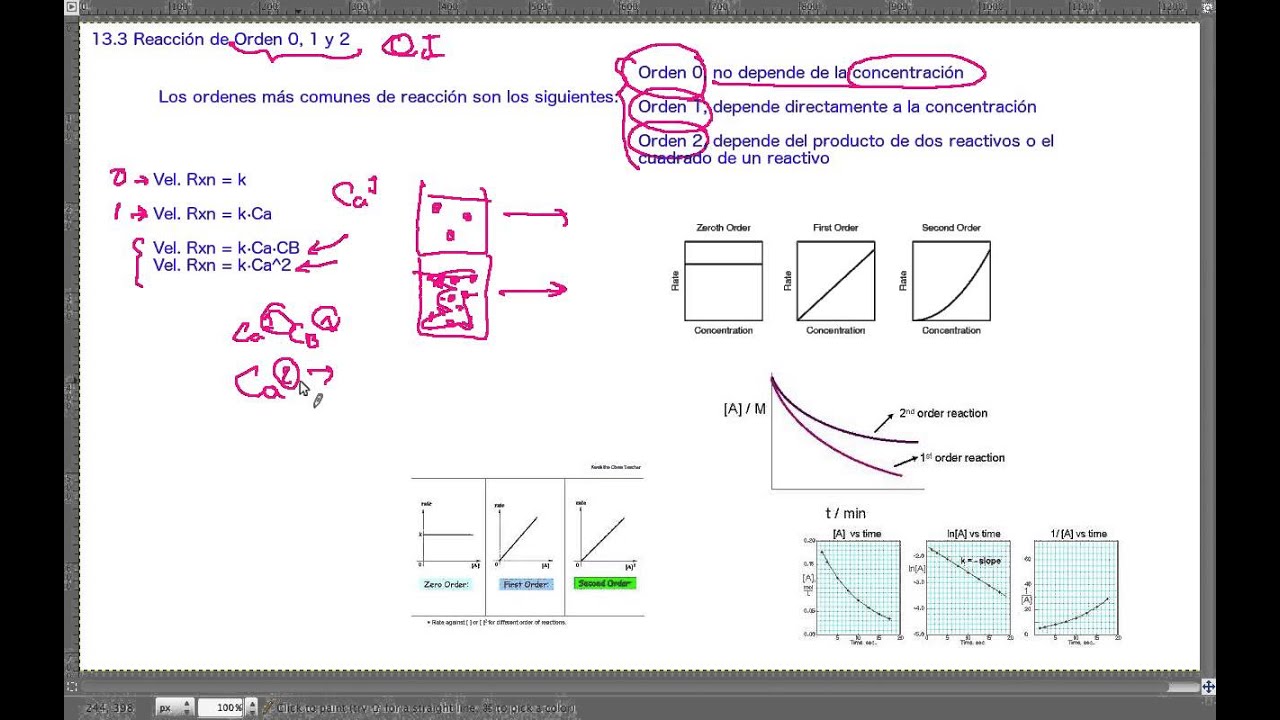
Reacciones de orden 0
Las reacciones de orden 0 son aquellas en las que la velocidad de reacción no depende de la concentración de los reactivos. En otras palabras, la velocidad de reacción es constante a lo largo del tiempo, independientemente de cuánto se modifiquen las concentraciones de los reactivos. Esto puede parecer contradictorio, ya que normalmente esperamos que al aumentar la concentración de los reactivos, la velocidad de reacción también aumente. Sin embargo, en las reacciones de orden 0, la velocidad de reacción está determinada únicamente por factores como la temperatura, la presión, la superficie de contacto y la presencia de catalizadores.
Un ejemplo común de una reacción de orden 0 es la descomposición del peróxido de hidrógeno. Esta reacción se produce de forma constante a una velocidad específica, sin importar cuánto se modifiquen las concentraciones del peróxido de hidrógeno. Sin embargo, es importante destacar que las reacciones de orden 0 son poco comunes y no se encuentran con frecuencia en la naturaleza.
Reacciones de orden 1
Las reacciones de orden 1 son aquellas en las que la velocidad de reacción es directamente proporcional a la concentración de un solo reactivo. Esto significa que si duplicamos la concentración del reactivo, la velocidad de reacción también se duplicará. Matemáticamente, esto se expresa como:
Velocidad = k[A]
Donde k es la constante de velocidad y [A] es la concentración del reactivo.
Un ejemplo común de una reacción de orden 1 es la descomposición del etanol. En presencia de catalizadores, el etanol se descompone a una velocidad que es directly proporcional a la concentración del etanol presente. Esto significa que si aumentamos la concentración de etanol, la velocidad de reacción también aumentará proporcionalmente.
Reacciones de orden 2
Las reacciones de orden 2 son aquellas en las que la velocidad de reacción es directamente proporcional al producto de la concentración de dos reactivos. Esto significa que si duplicamos la concentración de cualquiera de los reactivos, la velocidad de reacción se cuadruplicará. Matemáticamente, esto se expresa como:
Velocidad = k[A][B]
Donde k es la constante de velocidad y [A] y [B] son las concentraciones de los reactivos.
Un ejemplo común de una reacción de orden 2 es la reacción entre el peróxido de hidrógeno y el yoduro de potasio. La velocidad de esta reacción es directamente proporcional al producto de las concentraciones de peróxido de hidrógeno y yoduro de potasio presentes. Si aumentamos las concentraciones de ambos reactivos, la velocidad de reacción también aumentará proporcionalmente.
En resumen, las reacciones de orden 0, 1 y 2 son conceptos clave en la química, ya que nos permiten comprender cómo cambia la velocidad de reacción en relación con la concentración de los reactivos. Comprender estos conceptos puede ser fundamental para el diseño y la optimización de procesos químicos en diversas industrias.
1. ¿Qué determina el orden de una reacción?
El orden de una reacción está determinado por cómo varía la velocidad de reacción en relación con la concentración de los reactivos. En el caso de las reacciones de orden 0, 1 y 2, la velocidad de reacción puede ser constante, proporcional a la concentración de un solo reactivo o proporcional al producto de las concentraciones de dos reactivos, respectivamente.
2. ¿Cuál es la diferencia entre las reacciones de orden 0, 1 y 2?
La diferencia principal entre las reacciones de orden 0, 1 y 2 radica en cómo varía la velocidad de reacción con respecto a la concentración de los reactivos. En las reacciones de orden 0, la velocidad de reacción es constante e independiente de las concentraciones. En las reacciones de orden 1, la velocidad de reacción es proporcional a la concentración de un solo reactivo. En las reacciones de orden 2, la velocidad de reacción es proporcional al producto de las concentraciones de dos reactivos.
3. ¿Por qué son importantes las reacciones de orden 0, 1 y 2?
Las reacciones de orden 0, 1 y 2 son importantes porque nos permiten comprender y controlar la velocidad de reacción en diversos procesos químicos. Comprender el orden de una reacción es fundamental para diseñar procesos eficientes y optimizar la producción de productos químicos en industrias como la farmacéutica, la alimentaria y la química en general.