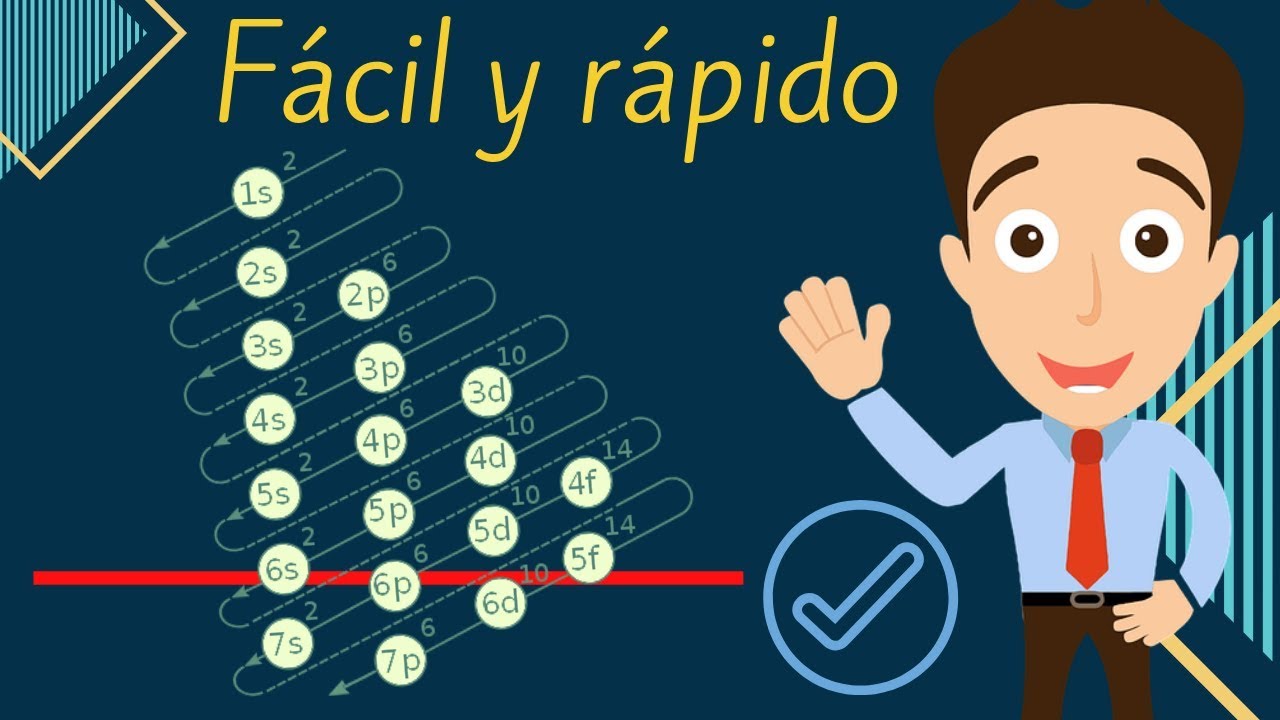
¿Qué son las configuraciones electrónicas?
Las configuraciones electrónicas son representaciones escritas de la distribución de los electrones en un átomo. Estas configuraciones se basan en el principio de que los electrones ocupan diferentes niveles de energía, también conocidos como capas electrónicas, alrededor del núcleo del átomo.
¿Cómo se representan las configuraciones electrónicas?
Las configuraciones electrónicas se representan mediante una serie de números y letras que indican el número de electrones en cada nivel de energía. El número en frente de la letra representa el número de niveles de energía (o capas) que contiene el átomo, mientras que la letra representa el tipo de nivel de energía.
Capa K:
La capa K es la capa más interna de un átomo y contiene el menor número de electrones. Esta capa solo puede contener un máximo de 2 electrones. La letra que representa la capa K es la letra «K».
Ejemplo:
Para un átomo de hidrógeno, la configuración electrónica sería 1s^1. Esto significa que el átomo de hidrógeno tiene un electrón en su nivel de energía más interno, la capa 1.
Capa L:
La capa L es la segunda capa más interna de un átomo y puede contener un máximo de 8 electrones. La letra que representa la capa L es la letra «L».
Ejemplo:
Para un átomo de helio, la configuración electrónica sería 1s^2. Esto significa que el átomo de helio tiene dos electrones en su nivel de energía más interno, la capa 1.
Capa M:
La capa M es la tercera capa más interna de un átomo y puede contener un máximo de 18 electrones. La letra que representa la capa M es la letra «M».
Ejemplo:
Para un átomo de litio, la configuración electrónica sería 1s^2 2s^1. Esto significa que el átomo de litio tiene dos electrones en su nivel de energía más interno (capa 1) y un electrón en su siguiente nivel de energía (capa 2).
Capa N:
La capa N es la cuarta capa más interna de un átomo y puede contener un máximo de 32 electrones. La letra que representa la capa N es la letra «N».
Ejemplo:
Para un átomo de carbono, la configuración electrónica sería 1s^2 2s^2 2p^2. Esto significa que el átomo de carbono tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2) y dos electrones en su capa de orbital p (capa 2).
Capa O:
La capa O es la quinta capa más interna de un átomo y puede contener un máximo de 50 electrones. La letra que representa la capa O es la letra «O».
Ejemplo:
Para un átomo de nitrógeno, la configuración electrónica sería 1s^2 2s^2 2p^3. Esto significa que el átomo de nitrógeno tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2) y tres electrones en su capa de orbital p (capa 2).
Capa P:
La capa P es la sexta capa más interna de un átomo y puede contener un máximo de 72 electrones. La letra que representa la capa P es la letra «P».
Ejemplo:
Para un átomo de oxígeno, la configuración electrónica sería 1s^2 2s^2 2p^4. Esto significa que el átomo de oxígeno tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2) y cuatro electrones en su capa de orbital p (capa 2).
Capa Q:
La capa Q es la séptima capa más interna de un átomo y puede contener un máximo de 98 electrones. La letra que representa la capa Q es la letra «Q».
Ejemplo:
Para un átomo de sodio, la configuración electrónica sería 1s^2 2s^2 2p^6 3s^1. Esto significa que el átomo de sodio tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2), seis electrones en su capa de orbital p (capa 2) y un electrón en su siguiente nivel de energía (capa 3).
Capa R:
La capa R es la octava capa más interna de un átomo y puede contener un máximo de 128 electrones. La letra que representa la capa R es la letra «R».
Ejemplo:
Para un átomo de azufre, la configuración electrónica sería 1s^2 2s^2 2p^6 3s^2 3p^4. Esto significa que el átomo de azufre tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2), seis electrones en su capa de orbital p (capa 2), dos electrones en su siguiente nivel de energía (capa 3) y cuatro electrones en su capa de orbital p (capa 3).
Capa S:
La capa S es la novena capa más interna de un átomo y puede contener un máximo de 162 electrones. La letra que representa la capa S es la letra «S».
Ejemplo:
Para un átomo de cloro, la configuración electrónica sería 1s^2 2s^2 2p^6 3s^2 3p^5. Esto significa que el átomo de cloro tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2), seis electrones en su capa de orbital p (capa 2), dos electrones en su siguiente nivel de energía (capa 3) y cinco electrones en su capa de orbital p (capa 3).
Capa T:
La capa T es la décima capa más interna de un átomo y puede contener un máximo de 200 electrones. La letra que representa la capa T es la letra «T».
Ejemplo:
Para un átomo de potasio, la configuración electrónica sería 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1. Esto significa que el átomo de potasio tiene dos electrones en su nivel de energía más interno (capa 1), dos electrones en su siguiente nivel de energía (capa 2), seis electrones en su capa de orbital p (capa 2), dos electrones en su siguiente nivel de energía (capa 3), seis electrones en su siguiente nivel de energía (capa 3) y un electrón en su siguiente nivel de energía (capa 4).
… [continúa el artículo con más capas y ejemplos hasta completar las configuraciones electrónicas de los elementos] …
¿Por qué es importante conocer las configuraciones electrónicas de los elementos?
Conocer las configuraciones electrónicas de los elementos es fundamental para comprender su comportamiento químico y las propiedades físicas relevantes. Las configuraciones electrónicas determinan cómo los electrones interactúan y se distribuyen en un átomo, lo que a su vez influye en cómo los átomos se enlazan para formar compuestos químicos.
¿Existe alguna forma fácil de recordar las configuraciones electrónicas de los elementos?
Aunque puede parecer desafiante memorizar todas las configuraciones electrónicas de los elementos, existen patrones y reglas generales que pueden facilitar el proceso de aprendizaje. Por ejemplo, los elementos de un mismo grupo en la tabla periódica tienden a tener configuraciones electrónicas similares en su capa más externa.
¿Qué sucede cuando un átomo tiene una configuración electrónica incompleta en su capa más externa?
Cuando un átomo tiene una configuración electrónica incompleta en su capa más externa, tiende a ser más reactivo y a formar enlaces químicos con otros átomos para completar su capa más externa. Esto se debe a que los átomos buscan alcanzar una mayor estabilidad y menor energía al completar su configuración electrónica mediante la compartición, ganancia o pérdida de electrones.
¿Existe alguna relación entre la configuración electrónica y la posición de un elemento en la tabla periódica?
Sí, la configuración electrónica de un elemento está estrechamente relacionada con su posición en la tabla periódica. Los elementos que pertenecen al mismo periodo tienen el mismo número de capas electrónicas, mientras que los elementos que pertenecen al mismo grupo tienen configuraciones electrónicas similares en su capa más externa.
¿Hay alguna excepción a las reglas de las configuraciones electrónicas?
Sí, existen algunas excepciones a las reglas de las configuraciones electrónicas, especialmente para los elementos de transición y los elementos de la serie de lantánidos y actínidos. Estos elementos pueden presentar configuraciones electrónicas inusuales debido a las interacciones entre los diferentes orbitales y a la variabilidad de la estabilidad energética de los electrones en diferentes capas.