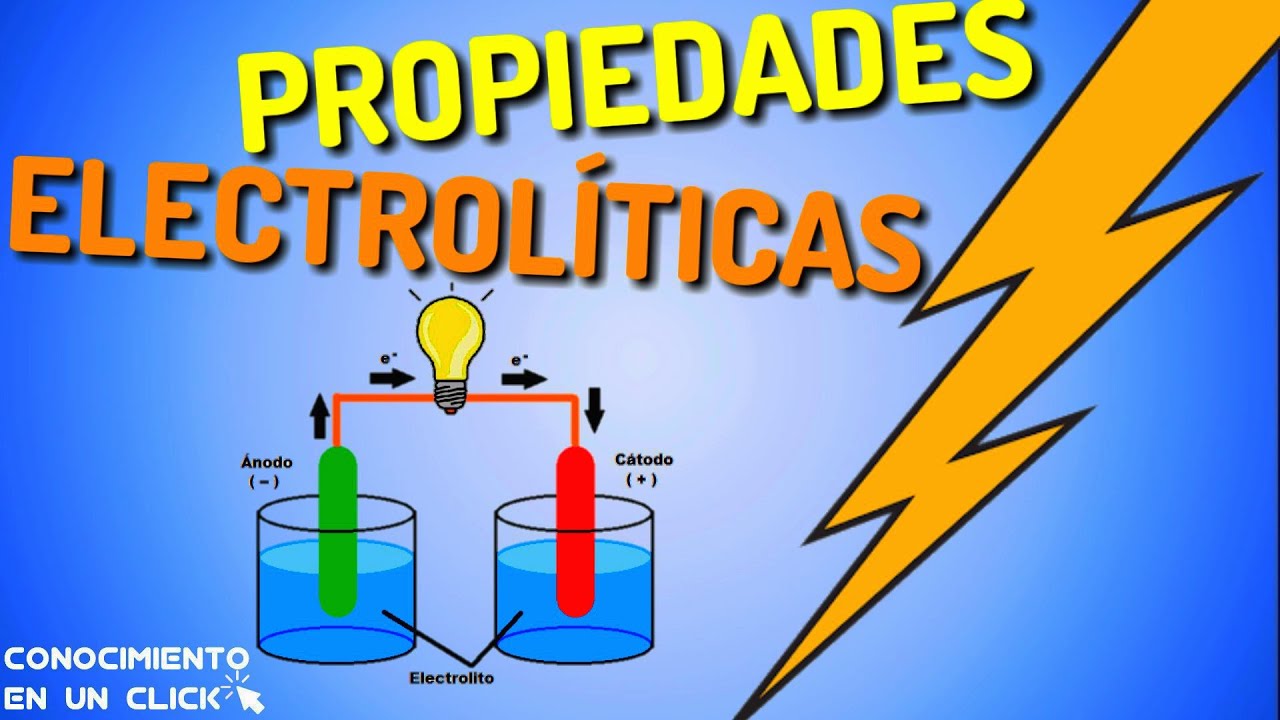
¿Qué son las sustancias electrolíticas?
Las sustancias electrolíticas son compuestos químicos que tienen la capacidad de disolverse en agua y generar iones, es decir, partículas cargadas eléctricamente. Estos iones pueden ser positivos, conocidos como cationes, o negativos, denominados aniones. Al disociarse parcialmente en agua, las sustancias electrolíticas permiten que se establezcan corrientes eléctricas en la solución.
¿Cómo se disocian parcialmente?
Cuando una sustancia electrolítica se disuelve en agua, las moléculas del compuesto se separan en iones positivos y negativos. Esto ocurre debido a la polaridad del agua, ya que su molécula tiene un extremo ligeramente negativo (el oxígeno) y otro ligeramente positivo (los hidrógenos). Los iones positivos son atraídos hacia el extremo negativo del agua, mientras que los iones negativos son atraídos hacia el extremo positivo.
Una vez que la sustancia electrolítica se encuentra en la solución, los iones quedan rodeados de moléculas de agua, formando lo que se conoce como una esfera de solvatación. Esta esfera permite que los iones se mantengan estables en la solución y se movilicen libremente.
Denominación correcta de las sustancias electrolíticas
Las sustancias electrolíticas se pueden clasificar en diferentes categorías según el grado de disociación de sus moléculas en iones. A continuación, detallaremos las tres principales categorías:
Electrolitos fuertes:
Los electrolitos fuertes son sustancias que se disocian completamente en agua, es decir, todas sus moléculas se separan en iones. Esto significa que se puede obtener una alta concentración de iones en la solución. Ejemplos de electrolitos fuertes son el cloruro de sodio (NaCl) y el ácido clorhídrico (HCl).
Electrolitos débiles:
Los electrolitos débiles son sustancias que se disocian parcialmente en agua, es decir, solo algunas de sus moléculas se separan en iones. Esto significa que la concentración de iones en la solución es menor en comparación con los electrolitos fuertes. Ejemplos de electrolitos débiles son el ácido acético (CH3COOH) y el ácido carbónico (H2CO3).
Electrolitos no electrolíticos:
Los electrolitos no electrolíticos son sustancias que no se disocian en iones en agua, es decir, no generan corriente eléctrica cuando se disuelven. Esto se debe a que sus moléculas no tienen la capacidad de separarse en iones. Ejemplos de electrolitos no electrolíticos son la sacarosa (C12H22O11) y el alcohol etanol (C2H5OH).
¿Por qué es importante comprender la disociación de las sustancias electrolíticas?
La comprensión de la disociación de las sustancias electrolíticas es fundamental en campos como la química, la medicina y la biología. Por ejemplo, en la química analítica, la capacidad de una sustancia para disociarse parcialmente en iones puede afectar la precisión de los análisis químicos.
En medicina, el conocimiento de la disociación de los electrolitos es esencial para entender cómo funcionan los electrolitos en el cuerpo y qué efectos pueden tener en la salud. Por ejemplo, el desequilibrio de electrolitos en el organismo puede causar problemas como deshidratación, arritmias cardíacas y trastornos del equilibrio ácido-base.
En biología, la disociación de las sustancias electrolíticas es relevante en procesos como la transmisión de señales en el sistema nervioso, en donde los iones son fundamentales para la generación de impulsos eléctricos.
Las sustancias electrolíticas son compuestos químicos que se disocian parcialmente en agua, generando iones positivos y negativos. Estos iones son fundamentales para el establecimiento de corrientes eléctricas en la solución. Comprender la disociación de las sustancias electrolíticas y su denominación correcta es esencial en diversas áreas de estudio. Su conocimiento nos permite entender cómo se comportan estas sustancias en diferentes contextos y cómo afectan a la química, la medicina y la biología.
¿Existen sustancias que no sean electrolíticas?
Sí, existen sustancias que no se disocian en iones en agua y, por lo tanto, no son electrolíticas. Estas sustancias son conocidas como electrolitos no electrolíticos, y ejemplos de ellos son la sacarosa y el alcohol etanol.
¿Cuál es la diferencia entre electrolitos fuertes y débiles?
La diferencia entre los electrolitos fuertes y débiles radica en el grado de disociación de sus moléculas en iones. Los electrolitos fuertes se disocian completamente en agua, mientras que los electrolitos débiles se disocian parcialmente.
¿Cuál es la importancia de los electrolitos en el cuerpo humano?
Los electrolitos son fundamentales para el correcto funcionamiento del cuerpo humano. Son responsables de mantener el equilibrio de líquidos en el organismo, permiten la transmisión de señales eléctricas en el sistema nervioso y participa en procesos como la contracción muscular. Un desequilibrio en los niveles de electrolitos puede causar problemas de salud.