¿Qué es la ley de Boyle y por qué es importante?
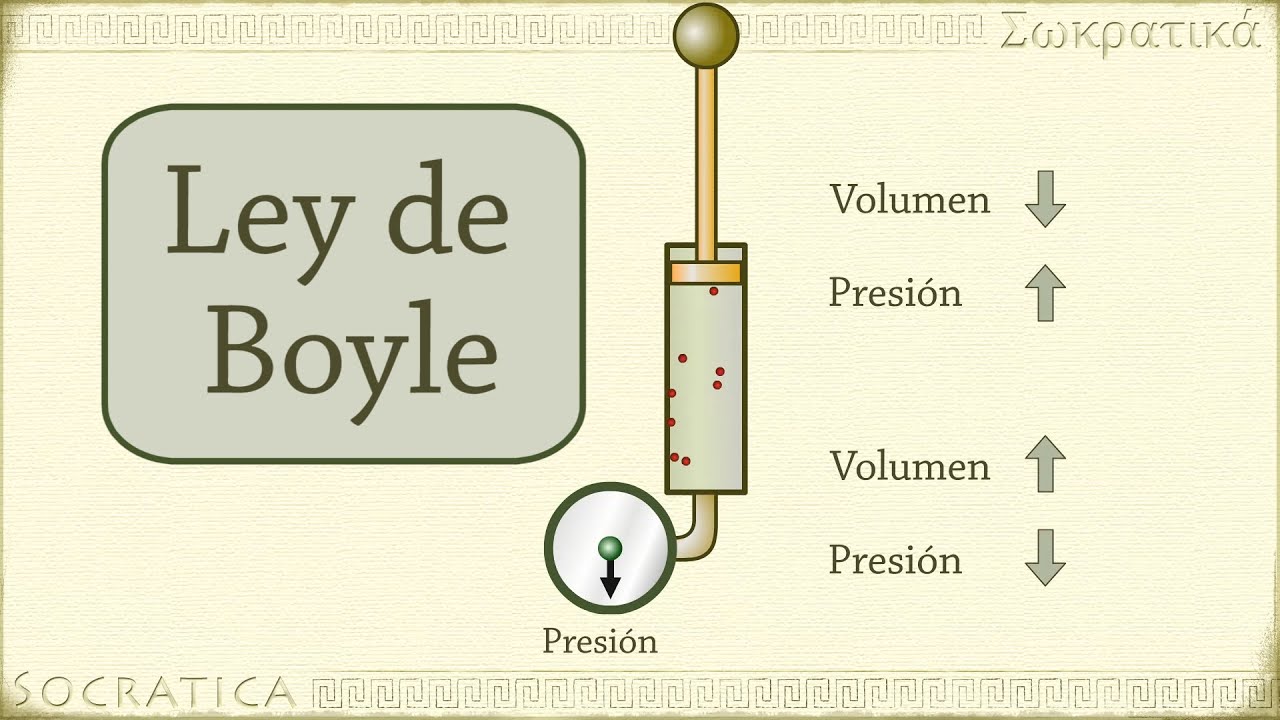
La ley de Boyle, también conocida como la ley de la compresibilidad de los gases, establece la relación inversamente proporcional entre la presión y el volumen de un gas a temperatura constante. Esta importante ley fue descubierta por el científico irlandés Robert Boyle en el siglo XVII y sentó las bases para comprender el comportamiento de los gases y su aplicación en numerosos campos científicos y tecnológicos.
¿Cuál es la fórmula matemática de la ley de Boyle?
La fórmula matemática que representa la ley de Boyle es la siguiente:
P1 * V1 = P2 * V2
Donde P1 y V1 representan la presión y el volumen iniciales, respectivamente, y P2 y V2 son la presión y el volumen finales. Esta fórmula establece que el producto de la presión inicial y el volumen inicial es igual al producto de la presión final y el volumen final.
Paso a paso: comprendiendo la ley de Boyle
Paso 1: Observación de un fenómeno
El descubrimiento de la ley de Boyle surgió a partir de la observación de un fenómeno en el que se inflaba un globo. Boyle notó que al aumentar la presión sobre el globo, su volumen disminuía, y viceversa. Esta observación inicial fue crucial para el posterior desarrollo de la ley.
Paso 2: Experimento con un tubo de vidrio
Para probar sus suposiciones, Boyle realizó un experimento utilizando un tubo de vidrio con un émbolo en un extremo. Al introducir aire en el tubo y presionar el émbolo, notó que la disminución del volumen se correspondía con un aumento proporcional en la presión.
Paso 3: Registro y análisis de los datos
Boyle realizó múltiples mediciones de presión y volumen en diferentes condiciones para poder establecer una relación precisa entre estas dos variables. Después de registrar y analizar los datos, llegó a la conclusión de que la relación era inversamente proporcional.
Paso 4: Formulación de la ley de Boyle
Basado en sus experimentos y análisis de datos, Boyle formuló la ley que lleva su nombre. Esta ley establece que, a temperatura constante, el producto de la presión y el volumen de un gas es constante. En otras palabras, si se aumenta la presión sobre un gas, su volumen disminuirá, y si se reduce la presión, su volumen aumentará.
Aplicaciones y ejemplos prácticos de la ley de Boyle
La ley de Boyle tiene una amplia gama de aplicaciones en la vida cotidiana y en diversos campos científicos. Algunos ejemplos prácticos de su aplicación incluyen:
– Respiración: Durante la inhalación, los pulmones expanden su volumen al disminuir la presión interna, permitiendo la entrada de aire. Durante la exhalación, los pulmones reducen su volumen al aumentar la presión interna, expulsando el aire.
– Neumáticos de automóviles: Los neumáticos funcionan utilizando la ley de Boyle. Al inflar el neumático, se aumenta la presión interna, lo que disminuye el volumen y permite que el neumático mantenga su forma y soporte el peso del vehículo.
– Buceo: La ley de Boyle es crucial en el buceo, ya que ayuda a comprender la relación entre la presión del aire y el volumen de los gases respirados bajo el agua. A medida que un buzo desciende en el agua, la presión aumenta y el volumen de los gases respirados disminuye, lo que puede conducir a problemas si no se controla adecuadamente.
Estos son solo algunos ejemplos de cómo la ley de Boyle se aplica en la vida cotidiana y en diversos campos científicos y tecnológicos. Su comprensión es fundamental para diversos estudios y profesiones, como la física, la química, la medicina y la ingeniería.
1. ¿La ley de Boyle solo se aplica a los gases?
La ley de Boyle se aplica principalmente a los gases, ya que estos tienen la capacidad de expandirse y comprimirse en función de la presión aplicada. Sin embargo, también se pueden observar efectos similares en otros sistemas de compresión, como los líquidos.
2. ¿Qué sucede si la temperatura cambia en la ley de Boyle?
La ley de Boyle asume una temperatura constante. Si la temperatura cambia, esta ley ya no se aplicaría directamente, y se necesitarían otras leyes, como la ley de Charles o la ley de Gay-Lussac, para describir el comportamiento de gases a diferentes temperaturas.
3. ¿Cuál es la importancia de la ley de Boyle en la industria?
La ley de Boyle es de gran importancia en la industria, especialmente en el diseño y funcionamiento de sistemas de compresión, como compresores de aire, bombas de vacío y sistemas de refrigeración. Además, esta ley es fundamental para la comprensión de la termodinámica y la mecánica de fluidos, lo que permite el desarrollo de tecnologías más eficientes y seguras.
En conclusión, la ley de Boyle es una ley fundamental en la ciencia que establece la relación entre la presión y el volumen de un gas a temperatura constante. Su comprensión y aplicación práctica permiten el avance en diversos campos científicos y tecnológicos, y su relevancia se extiende a la vida cotidiana. Es importante conocer y comprender esta ley para obtener un mayor conocimiento del mundo que nos rodea.