La antigua idea de los átomos
Desde los tiempos de los antiguos filósofos griegos, la idea de la existencia de partículas indivisibles, los átomos, ha capturado la imaginación de las mentes curiosas. El término «átomo» proviene del griego «atomos», que significa «indivisible». Sin embargo, la idea de los átomos como partículas pequeñas y fundamentales todavía estaba lejos de ser comprendida en aquel entonces.
Demócrito y la teoría atómica
Uno de los primeros pensadores en desarrollar una teoría sobre los átomos fue Demócrito, un filósofo griego del siglo V a.C. Según Demócrito, toda la materia estaba formada por partículas extremadamente pequeñas llamadas átomos, que eran indivisibles y no podían ser destruidos. Estos átomos eran diferentes en forma y tamaño, y se movían en el vacío. Su teoría atómica, aunque con poca evidencia experimental en ese momento, sentó las bases para futuras investigaciones y desarrollos en el campo.
Las ideas de Leucipo y Aristóteles
Leucipo, contemporáneo de Demócrito, también contribuyó a la teoría atómica al afirmar que el vacío existía y que los átomos se movían en él. Sin embargo, fue Aristóteles quien, con su influencia dominante en la filosofía y la ciencia de su tiempo, generó cierta controversia en relación a la teoría atómica. Aristóteles negó la existencia de los átomos y promovió una visión más «holística» de la materia, argumentando que todo estaba compuesto por cuatro elementos básicos: tierra, agua, aire y fuego.
La revolución científica y la teoría atómica
No fue hasta la época de la revolución científica que la teoría atómica comenzó a ser reconsiderada seriamente. Los avances en la tecnología y el desarrollo de nuevas técnicas experimentales permitieron a los científicos adentrarse en la naturaleza de la materia a un nivel más profundo.
El descubrimiento del electrón
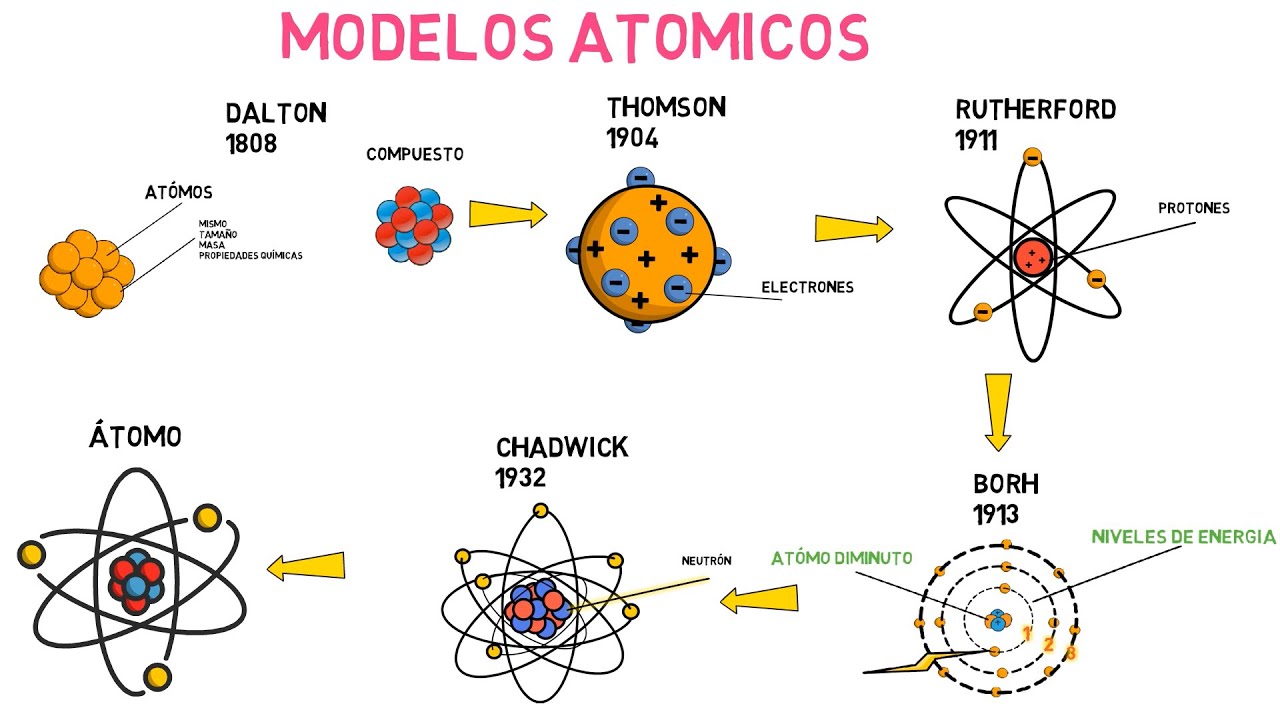
A finales del siglo XIX, el científico británico Joseph John Thomson realizó experimentos con tubos de rayos catódicos, que producían un haz de partículas cargadas negativamente llamadas electrones. Thomson descubrió que los electrones tenían una carga y una masa muy pequeñas, y propuso un nuevo modelo atómico llamado el «modelo del pudín de pasas», donde los electrones estaban incrustados en una masa positiva, como las pasas en un pudín.
El experimento de la lámina de oro
En 1909, el científico neozelandés Ernest Rutherford llevó a cabo un famoso experimento utilizando partículas alfa (núcleos de helio) para bombardear una delgada lámina de oro. Esperaba que las partículas alfa pasaran a través de la lámina sin desviarse en gran medida, siguiendo el modelo del pudín de pasas de Thomson. Sin embargo, para su sorpresa, algunas partículas alfa fueron desviadas en ángulos grandes y algunas incluso rebotaron hacia atrás.
El modelo nuclear del átomo
Basado en los resultados del experimento de la lámina de oro, Rutherford propuso un nuevo modelo atómico conocido como el «modelo nuclear». Según este modelo, la mayor parte de la masa y la carga positiva del átomo se concentran en un núcleo pequeño y denso en el centro, mientras que los electrones giran alrededor del núcleo en órbitas circulares.
La teoría cuántica y la estructura del átomo
A principios del siglo XX, los científicos se enfrentaron a nuevos desafíos en la comprensión de la estructura del átomo. El modelo de Rutherford presentaba algunas inconsistencias, especialmente en relación con el comportamiento de los electrones. Fue entonces cuando la teoría cuántica emergió como una nueva forma de entender la naturaleza microscópica de la materia.
El modelo de Bohr y los niveles de energía
En 1913, el físico danés Niels Bohr propuso un modelo atómico que incorporaba los conceptos de la teoría cuántica. Según el modelo de Bohr, los electrones giran alrededor del núcleo en órbitas circulares definidas y estables, y cada órbita tiene una energía específica. Cuando los electrones absorben o emiten energía, saltan a órbitas superiores o regresan a órbitas inferiores, respectivamente.
El modelo actual: átomos y partículas subatómicas
El modelo actual de la teoría atómica se basa en la mecánica cuántica y reconoce que los electrones no se mueven en órbitas definidas, sino que existen en regiones de alta probabilidad llamadas «orbitales». Además de los electrones, se han descubierto otras partículas subatómicas, como los protones y los neutrones, que componen el núcleo del átomo.
¿Cuál es la importancia de la teoría atómica?
La teoría atómica ha sido fundamental para nuestra comprensión de la naturaleza de la materia y ha sentado las bases para muchos desarrollos científicos y tecnológicos. Es la clave para entender la química, la física y otras disciplinas científicas relacionadas. Además, la investigación en el campo de la teoría atómica ha llevado al descubrimiento de numerosas aplicaciones prácticas, como la energía nuclear, la medicina nuclear y la nanotecnología.
¿Cuáles son los desafíos actuales en el estudio de la teoría atómica?
Aunque hemos logrado avances significativos en la comprensión de la estructura y el comportamiento de los átomos, aún quedan muchos misterios por resolver. Por ejemplo, comprendemos poco sobre la naturaleza de la materia oscura y la energía oscura, que constituyen la mayor parte del universo observable. Además, el desarrollo de modelos teóricos más precisos y la capacidad de estudiar átomos individuales en tiempo real son áreas de investigación en constante evolución.
En conclusión
La evolución de la teoría atómica ha sido un fascinante viaje a lo largo de la historia de la ciencia. Desde las ideas iniciales de filósofos antiguos hasta los modelos más sofisticados y complejos de la actualidad, nuestra comprensión de los átomos y de la estructura de la materia continúa expandiéndose. A medida que avanzamos en el estudio de la teoría atómica, es emocionante pensar en las posibilidades futuras y en cómo estas revelaciones puedan alterar nuestra comprensión del universo y transformar nuestra forma de vida.