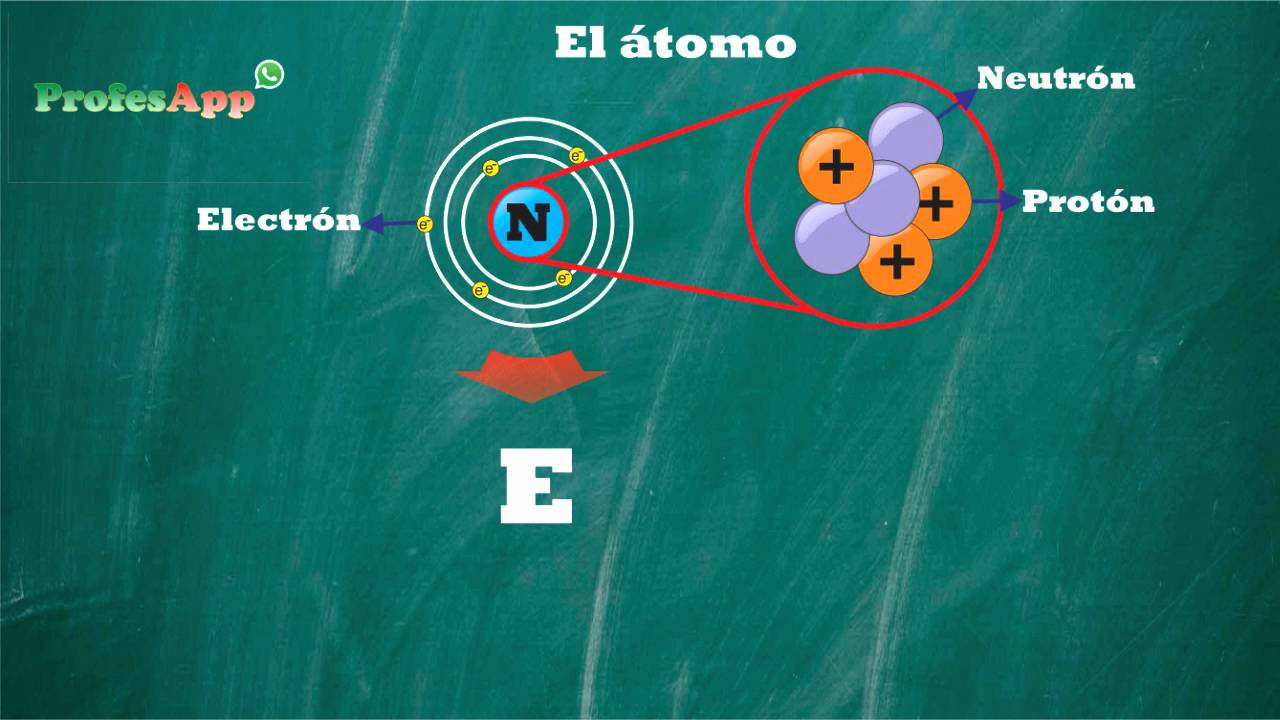
El átomo, una de las unidades fundamentales de la materia, es una estructura fascinante compuesta por diversos componentes. A través del estudio de su estructura, podemos adentrarnos en el mundo microscópico y comprender mejor cómo interactúan los elementos a nivel molecular.
Componentes principales del átomo
El átomo está compuesto por tres componentes principales: protones, neutrones y electrones. Cada uno de estos componentes desempeña un papel fundamental en las propiedades y comportamiento de los átomos.
Protones
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo. Tienen una masa aproximadamente igual a la masa del neutrón y son responsables de darle al átomo su carga eléctrica. La cantidad de protones en un átomo determinado se conoce como su número atómico y define su identidad química.
Neutrones
Los neutrones, al igual que los protones, se encuentran en el núcleo del átomo. Sin embargo, a diferencia de los protones, los neutrones tienen carga neutra, lo que significa que no tienen carga eléctrica. Su principal función es mantener unida la estructura del núcleo atómico, ya que su presencia contrarresta la repulsión electrostática entre los protones.
Electrones
Los electrones son partículas muy ligeras con carga negativa que orbitan alrededor del núcleo del átomo en diferentes niveles de energía. Su movimiento se encuentra regulado por las leyes de la mecánica cuántica. Los electrones son responsables de las interacciones químicas entre los átomos y son los que permiten la formación de enlaces químicos.
¿Cómo se organizan los electrones en un átomo?
La organización de los electrones en un átomo se basa en el modelo del átomo de Bohr. Según este modelo, los electrones se distribuyen en diferentes niveles de energía o capas. La capa más cercana al núcleo puede contener hasta 2 electrones, mientras que las capas posteriores pueden contener hasta un máximo de 8 electrones.
¿Qué son los orbitales y cómo se relacionan con los electrones?
Los electrones dentro de cada capa se distribuyen en diferentes orbitales. Un orbital es una región del espacio donde hay mayor probabilidad de encontrar un electrón. Cada orbital puede contener un máximo de 2 electrones con espines opuestos. Los diferentes tipos de orbitales se representan mediante las letras s, p, d y f.
¿Cómo es posible representar la estructura electrónica de un átomo?
Para representar la estructura electrónica de un átomo, se utiliza la notación de configuración electrónica. Esta notación indica el número de electrones en cada nivel de energía y se representa utilizando letras y números. Por ejemplo, la configuración electrónica del átomo de carbono es 1s2 2s2 2p2, lo que indica que el carbono tiene 2 electrones en su nivel 1s, 2 electrones en su nivel 2s y 2 electrones en su nivel 2p.
¿Cuáles son las propiedades de los átomos?
Las propiedades de los átomos están determinadas por la cantidad de protones, neutrones y electrones que los componen, así como por la forma en que estos componentes interactúan entre sí. Algunas de las propiedades más importantes de los átomos incluyen su masa, tamaño, carga eléctrica y capacidad para formar enlaces químicos.
¿Cómo afecta la estructura del átomo a sus propiedades químicas?
La estructura del átomo, especialmente la distribución de electrones en los orbitales, tiene un impacto significativo en las propiedades químicas de un átomo. Por ejemplo, los átomos con una configuración electrónica completa en su capa de valencia tienden a ser más estables y reactivos, mientras que aquellos con niveles incompletos tienden a buscar la estabilidad mediante la formación de enlaces químicos con otros átomos.
¿Qué es la valencia y cómo se relaciona con la estructura del átomo?
La valencia se refiere al número de electrones que un átomo puede ganar, perder o compartir para formar enlaces químicos. La valencia de un átomo está influenciada por la cantidad de electrones en su capa de valencia. Por ejemplo, los átomos con 8 electrones en su capa de valencia tienden a ser estables y no reactivos, mientras que aquellos con menos de 8 electrones tienden a formar enlaces para completar su capa de valencia.
¿Cuál es la carga eléctrica de un átomo?
La carga eléctrica de un átomo depende de la cantidad de protones y electrones que posea. Si el número de protones y electrones es el mismo, el átomo será eléctricamente neutro. Si hay más protones que electrones, el átomo tendrá carga positiva, y si hay más electrones que protones, el átomo tendrá carga negativa.
¿Cuántos electrones puede tener un átomo en su capa de valencia?
El número máximo de electrones que puede tener un átomo en su capa de valencia depende de su número atómico y de la configuración electrónica. En general, la capa de valencia puede contener hasta un máximo de 8 electrones, aunque existen excepciones para algunos elementos de transición.
¿Cuál es la relación entre la estructura del átomo y las propiedades periódicas de los elementos?
La estructura del átomo, en particular la disposición de los electrones en los orbitales, está directamente relacionada con las propiedades periódicas de los elementos. A medida que se avanza en la tabla periódica de izquierda a derecha y de arriba a abajo, la estructura electrónica varía, lo que da lugar a diferentes propiedades químicas y físicas de los elementos.
¿Cómo se descubrió la estructura del átomo?
El descubrimiento de la estructura del átomo fue el resultado de décadas de investigación y contribuciones de diferentes científicos. Desde los primeros experimentos de Thomson con tubos de rayos catódicos, hasta el modelo atómico de Rutherford y el modelo cuántico moderno, la comprensión de la estructura del átomo ha evolucionado a lo largo del tiempo.
¿Por qué es importante entender la estructura del átomo?
Entender la estructura del átomo es fundamental para comprender los procesos químicos y físicos que ocurren a nivel molecular. Además, el conocimiento de la estructura atómica nos permite desarrollar tecnologías avanzadas, como la energía nuclear, los materiales semiconductores y los métodos de diagnóstico médico.