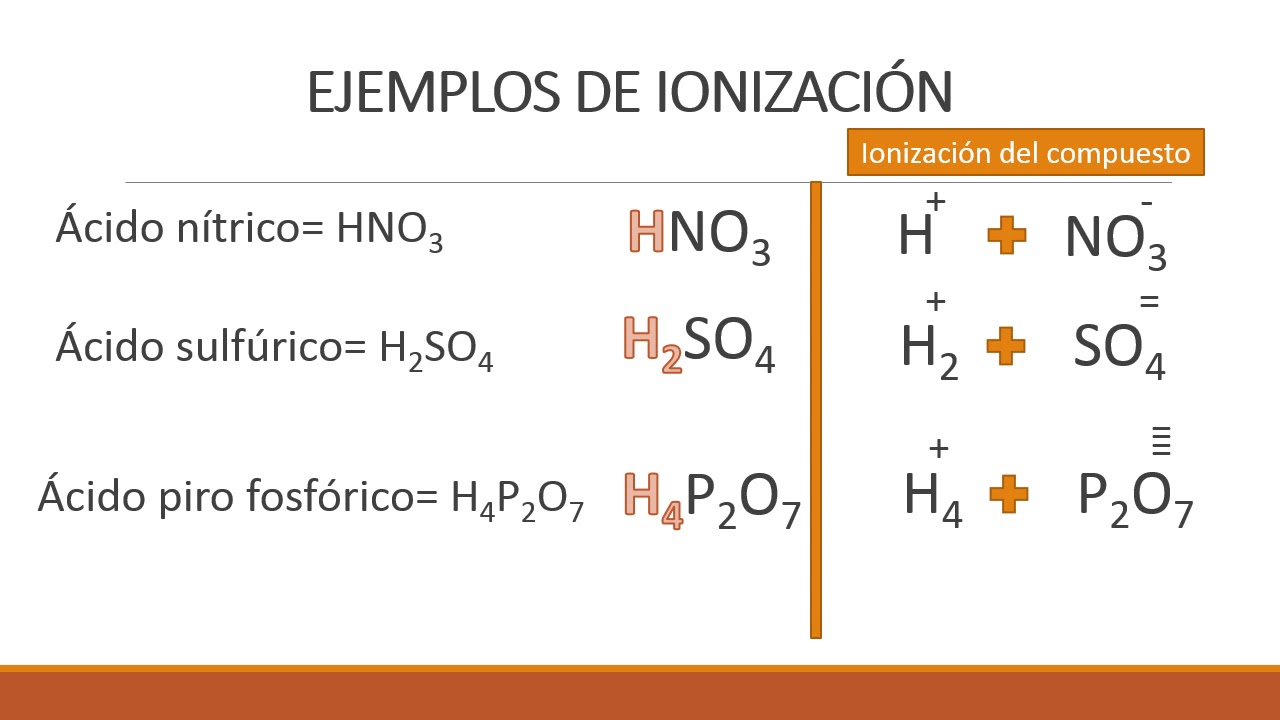
Uno de los conceptos fundamentales en la química es la ecuación de ionización. Se trata de una herramienta clave que nos permite entender cómo los compuestos se descomponen en iones en soluciones acuosas. En este artículo, nos enfocaremos en la ecuación de ionización del ácido acético y su importancia en la química.
¿Qué es el ácido acético?
El ácido acético es un compuesto químico que se encuentra de forma natural en una variedad de alimentos, como las frutas y el vinagre. También se produce de manera sintética y se utiliza en la industria alimentaria, farmacéutica y química. Su fórmula química es CH3COOH.
El ácido acético es famoso por su característico olor y sabor agrio. Además, es un componente principal del vinagre y se utiliza como conservante, saborizante y acidulante en diversas preparaciones culinarias y productos alimenticios.
La ecuación de ionización del ácido acético
La ecuación de ionización del ácido acético describe cómo este compuesto se disocia en iones en una solución acuosa. En el caso del ácido acético, la ecuación de ionización se representa de la siguiente manera:
CH3COOH ⇌ CH3COO– + H+
En esta ecuación, el ácido acético (CH3COOH) se disocia en un ion acetato (CH3COO–) y un ion hidrógeno (H+).
¿Por qué es importante la ecuación de ionización?
La ecuación de ionización es fundamental para comprender cómo los ácidos se comportan en soluciones acuosas y cómo interactúan con otros compuestos. Nos permite entender cómo los ácidos pueden donar iones hidrógeno y cómo estos iones pueden reaccionar con bases para formar nuevas sustancias.
En el caso del ácido acético, su ionización es especialmente relevante en la industria química y farmacéutica. Por ejemplo, el ácido acético se utiliza para la síntesis de diversos productos químicos, como productos químicos agrícolas, medicamentos, plásticos y fibras textiles. La capacidad del ácido acético para liberar ion hidrógeno es esencial para muchas de estas reacciones químicas.
Factores que afectan la ionización del ácido acético
Varios factores pueden influir en la ionización del ácido acético. Algunos de los más importantes son:
Concentración de la solución
La concentración de la solución acuosa de ácido acético puede tener un impacto en el grado de ionización. A medida que aumenta la concentración del ácido acético, la disociación en iones también aumenta.
pH de la solución
El pH de la solución puede afectar la ionización del ácido acético. A pH bajos, la ionización del ácido acético es mayor, mientras que a pH altos tiende a ser menos ionizado.
Temperatura
La temperatura también puede influir en la ionización del ácido acético. En general, a temperaturas más altas, la ionización es más rápida y más completa.
Aplicaciones del ácido acético y su ionización
El ácido acético y su ecuación de ionización tienen numerosas aplicaciones en diferentes campos:
Industria alimentaria
El ácido acético es ampliamente utilizado en la industria alimentaria como conservante, saborizante y acidulante. Su capacidad de liberar iones hidrógeno es clave para su acción conservante en la inhibición del crecimiento de microorganismos.
Fabricación de productos químicos
El ácido acético se utiliza en la síntesis de una amplia gama de productos químicos, como plásticos, fibras textiles, tintas y productos químicos agrícolas. Su ionización es esencial para llevar a cabo muchas de estas reacciones químicas.
Industria farmacéutica
En la industria farmacéutica, el ácido acético se utiliza en la fabricación de medicamentos y productos farmacéuticos. Su capacidad de liberación de iones hidrógeno es fundamental para la síntesis de muchos compuestos farmacéuticos.
¿El ácido acético siempre se ioniza en soluciones acuosas?
No, la ionización del ácido acético en soluciones acuosas es un equilibrio dinámico. Dependiendo de las condiciones, puede haber una disociación parcial o completa del ácido acético en iones.
¿Cuál es la importancia del ion hidrógeno en la ecuación de ionización del ácido acético?
El ion hidrógeno (H+) es fundamental en la ecuación de ionización del ácido acético, ya que representa la donación de un ion hidrógeno del ácido. Este ion puede reaccionar con otros compuestos, como bases, para formar nuevos productos químicos.
¿Cuál es el olor del ácido acético?
El ácido acético tiene un olor característico y agrio. Este olor se puede percibir en productos como el vinagre debido a la presencia de ácido acético.
En conclusión, la ecuación de ionización del ácido acético desempeña un papel fundamental en la comprensión del comportamiento de los ácidos en soluciones acuosas. Su capacidad para liberar iones hidrógeno es esencial en numerosas aplicaciones en la industria alimentaria, química y farmacéutica. Comprender esta ecuación nos proporciona una visión más completa de los procesos químicos y su importancia en nuestra vida diaria.