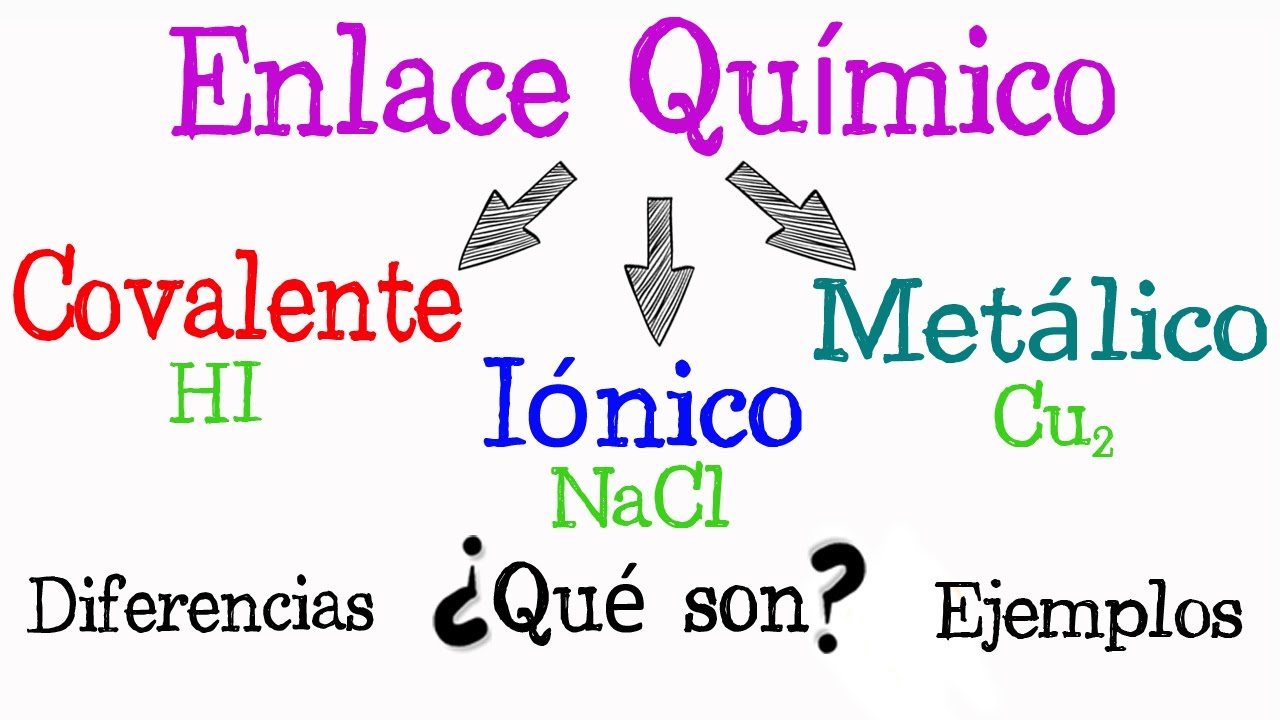
En el fascinante mundo de la química, los enlaces químicos son una parte fundamental del estudio de las sustancias y las reacciones químicas. Comprender cómo se forman y clasifican los enlaces químicos es esencial para comprender las propiedades de las sustancias y su comportamiento en diversas situaciones. En este artículo, te llevaré a través de un cuadro sinóptico de la clasificación de los enlaces químicos, que te proporcionará una visión completa y clara de este tema complejo pero apasionante.
El enlace iónico: cuando los opuestos se atraen
El enlace iónico es una de las formas más comunes de enlace químico. Se forma entre dos átomos cuando hay una transferencia completa de electrones de un átomo a otro. Uno de los átomos, llamado catión, pierde electrones y adquiere una carga positiva, mientras que el otro átomo, conocido como anión, gana electrones y adquiere una carga negativa. Esta atracción electrostática entre el catión y el anión resulta en la formación de un compuesto iónico.
Los compuestos iónicos tienen características únicas. Son sólidos cristalinos en su forma pura y tienen puntos de fusión y ebullición altos. Además, son buenos conductores de electricidad en estado fundido o en solución acuosa, pero no en estado sólido. Un ejemplo clásico de un compuesto iónico es el cloruro de sodio, comúnmente conocido como sal de mesa.
El enlace covalente: el compartir es cuidar
En contraste con el enlace iónico, el enlace covalente ocurre cuando dos átomos comparten electrones para completar su configuración electrónica. Este tipo de enlace es típicamente entre átomos no metálicos. El enlace covalente puede ser polar o no polar, dependiendo de la electronegatividad de los átomos involucrados.
En un enlace covalente polar, uno de los átomos atrae más fuertemente a los electrones compartidos, creando una distribución desigual de la carga negativa. Esto resulta en que el átomo más electronegativo tenga una carga parcialmente negativa y el otro átomo tenga una carga parcialmente positiva. Un ejemplo de un enlace covalente polar es el agua (H2O), donde el oxígeno atrae más fuertemente a los electrones compartidos que los átomos de hidrógeno.
Por otro lado, en un enlace covalente no polar, los dos átomos involucrados tienen la misma electronegatividad y, por lo tanto, comparten los electrones de manera equitativa. Esto da como resultado una distribución de carga neutral en la molécula. El dióxido de carbono (CO2) es un ejemplo de un enlace covalente no polar.
Los enlaces metálicos: una red de electrones libres
Los enlaces metálicos son diferentes de los enlaces iónicos y covalentes en el sentido de que no hay transferencia ni compartición de electrones específica entre átomos individuales. En cambio, los átomos metálicos forman una estructura en la que los electrones se desplazan libremente a través de la red cristalina. Esta «nube» de electrones móviles permite que los átomos metálicos se unan entre sí y da como resultado propiedades únicas, como la conductividad eléctrica y térmica, y la maleabilidad de los metales.
El enlace metálico es responsable de la formación de metales, como el oro, la plata y el hierro. Estos metales son conocidos por su brillo, su capacidad para ser martillados en láminas delgadas y su conductividad eléctrica.
Los enlaces intermoleculares: fuerzas entre moléculas
Además de los enlaces químicos intramoleculares, también existen fuerzas intermoleculares que actúan entre moléculas individuales en una sustancia. Estas fuerzas pueden ser dipolo-dipolo, fuerzas de dispersión o enlaces de hidrógeno.