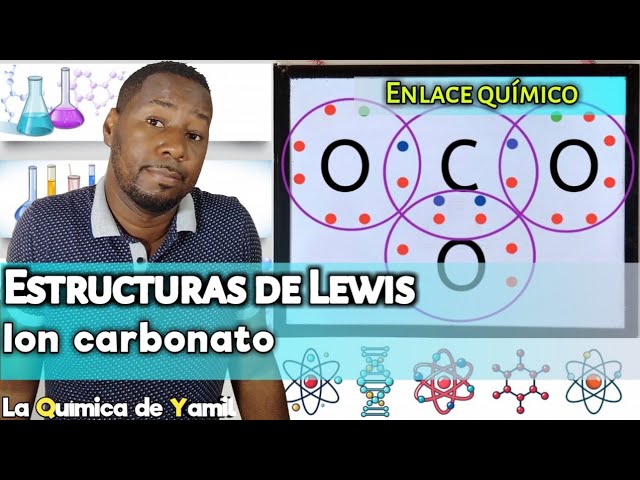
¿Qué es la estructura de Lewis del carbonato de calcio?
La estructura de Lewis del carbonato de calcio es una representación gráfica que muestra la distribución de electrones y la conectividad de los átomos en esta molécula. El carbonato de calcio (CaCO3) es un compuesto químico ampliamente encontrado en la naturaleza, como en los depósitos de rocas sedimentarias y en formaciones coralinas. Su estructura de Lewis nos brinda una comprensión visual de cómo se forman los enlaces y cómo los electrones están distribuidos entre los átomos de carbono, oxígeno y calcio.
Importancia de la estructura de Lewis del carbonato de calcio
La estructura de Lewis del carbonato de calcio es de vital importancia en el campo de la química y la ciencia de los materiales. Al comprender cómo se organizan los electrones y cómo los átomos están unidos en esta molécula, los científicos pueden predecir y comprender mejor las propiedades físicas y químicas del carbonato de calcio.
Esta comprensión tiene muchas aplicaciones prácticas en campos como la industria de la construcción, donde el carbonato de calcio se utiliza ampliamente como material de construcción y en la fabricación de cemento. También es esencial en la industria de la minería, ya que el carbonato de calcio es un mineral clave en la extracción de diversos productos como el yeso y el mármol. Además, el conocimiento de la estructura de Lewis del carbonato de calcio es fundamental en la investigación de fármacos y en la química ambiental.
¿Cómo se forma la estructura de Lewis del carbonato de calcio?
Para entender cómo se forma la estructura de Lewis del carbonato de calcio, primero debemos comprender la distribución de electrones en los átomos que lo componen. En el carbonato de calcio, hay un átomo de carbono (C), un átomo de calcio (Ca) y tres átomos de oxígeno (O). Cada uno de estos átomos tiene una configuración electrónica específica.
El átomo de carbono tiene una configuración electrónica de 1s2 2s2 2p2, lo que significa que tiene dos electrones en su capa interna y cuatro electrones de valencia distribuidos en su capa exterior. Por otro lado, el calcio tiene una configuración electrónica de 1s2 2s2 2p6 3s2 3p6 4s2, lo que significa que tiene dos electrones en su capa interna y dos electrones de valencia en su capa externa. Los átomos de oxígeno tienen una configuración electrónica de 1s2 2s2 2p4, lo que significa que tienen dos electrones en su capa interna y seis electrones de valencia.
En la estructura de Lewis del carbonato de calcio, el átomo de carbono forma enlaces covalentes con dos átomos de oxígeno, utilizando dos de sus electrones de valencia y dos electrones de valencia de cada átomo de oxígeno. Esto resulta en dos enlaces carbono-oxígeno y una estructura lineal.
El átomo de calcio, por su parte, se une a los átomos de oxígeno restantes utilizando dos de sus electrones de valencia y dos electrones de valencia de cada átomo de oxígeno. Esto da lugar a dos enlaces calcio-oxígeno y una estructura lineal.
La estructura de Lewis del carbonato de calcio se completa con una carga negativa en cada átomo de oxígeno, que corresponde a los dos electrones de valencia no compartidos.
Es importante tener en cuenta que la estructura de Lewis es una representación simplificada y no muestra la geometría real de la molécula. Sin embargo, nos proporciona información valiosa sobre los enlaces y la distribución de electrones.
Propiedades físicas y químicas del carbonato de calcio
El carbonato de calcio se presenta en diferentes formas, como el mármol, la tiza y la calcita, y tiene una amplia variedad de propiedades físicas y químicas. Algunas de las propiedades más destacadas son las siguientes:
1. Solubilidad: El carbonato de calcio es ligeramente soluble en agua, lo que significa que se disuelve en cantidades muy pequeñas. Sin embargo, su solubilidad aumenta con la presencia de dióxido de carbono (CO2) en el agua, lo que da lugar a la formación de bicarbonato de calcio.
2. Dureza: El carbonato de calcio tiene una dureza relativamente baja en la escala de Mohs, lo que significa que es fácilmente rayado por minerales más duros. Sin embargo, en forma de mármol, puede tener una dureza considerable dependiendo de la cantidad de impurezas presentes.
3. Reactividad ácido-base: El carbonato de calcio es un compuesto básico que reacciona con ácidos para formar sales de calcio, dióxido de carbono y agua. Esta reacción es la base del proceso de neutralización y es comúnmente utilizada en aplicaciones como la industria de alimentos y bebidas, donde se utiliza para regular el pH.
4. Estabilidad térmica: El carbonato de calcio tiene una alta estabilidad térmica, lo que significa que puede soportar altas temperaturas sin descomponerse. Esta propiedad lo hace útil en aplicaciones como la fabricación de materiales cerámicos y vidrios.
Usos y aplicaciones del carbonato de calcio
El carbonato de calcio tiene una amplia gama de usos y aplicaciones en diversas industrias. Algunos de los más comunes son:
1. Industria de la construcción: El carbonato de calcio se utiliza como agregado en la fabricación de hormigón y mortero. También se utiliza en la producción de materiales de construcción como tejas, ladrillos y yeso.
2. Industria química: El carbonato de calcio se utiliza en la fabricación de productos químicos como pinturas, plásticos, caucho y productos farmacéuticos. También se utiliza como aditivo en productos alimenticios y como suplemento de calcio en alimentos y bebidas.
3. Industria del papel: El carbonato de calcio se utiliza en la producción de papel y cartón para mejorar la resistencia, opacidad y blancura del producto final.
4. Industria de cosméticos: El carbonato de calcio se utiliza en la fabricación de productos cosméticos como polvos faciales, maquillaje y cremas dentales debido a su capacidad para absorber el exceso de aceites y proporcionar un efecto de suavidad en la piel.
5. Industria agrícola: El carbonato de calcio se utiliza como enmienda del suelo para corregir la acidez y mejorar la capacidad de retención de agua. También se utiliza en la producción de alimentos para animales y suplementos nutricionales.
1. ¿Cuál es la fórmula química del carbonato de calcio?
La fórmula química del carbonato de calcio es CaCO3, lo que significa que está compuesto por un átomo de calcio, un átomo de carbono y tres átomos de oxígeno.
2. ¿Cuál es la geometría molecular del carbonato de calcio?
La geometría molecular del carbonato de calcio es lineal, ya que los átomos de carbono, calcio y oxígeno están unidos en una línea recta.
3. ¿Cuál es la carga en cada átomo de oxígeno en la estructura de Lewis del carbonato de calcio?
En la estructura de Lewis del carbonato de calcio, cada átomo de oxígeno tiene una carga negativa para representar los dos electrones de valencia no compartidos.
4. ¿Cuál es la importancia de comprender la estructura de Lewis del carbonato de calcio?
Comprender la estructura de Lewis del carbonato de calcio es importante porque nos permite comprender mejor las propiedades físicas y químicas de esta molécula. Esto tiene aplicaciones prácticas en campos como la industria de la construcción, la minería, la química ambiental y la investigación farmacéutica.
5. ¿Cómo se representa la estructura de Lewis del carbonato de calcio?
La estructura de Lewis del carbonato de calcio se representa utilizando símbolos químicos para los átomos de carbono, calcio y oxígeno, junto con líneas que representan los enlaces covalentes y pares de electrones no compartidos.
6. ¿Cuál es la relación entre la estructura de Lewis y la geometría molecular?
La estructura de Lewis nos da información sobre cómo están unidos los átomos y cómo se distribuyen los electrones en una molécula, mientras que la geometría molecular nos brinda información sobre la disposición espacial de los átomos. Ambas son importantes para comprender las propiedades y comportamiento de las moléculas.