En el amplio campo de la ciencia, uno de los temas más fascinantes es el estudio de los átomos. A lo largo de la historia, los científicos han desarrollado diferentes teorías para comprender la estructura y comportamiento de estas diminutas partículas que componen la materia. En este artículo, exploraremos una tabla comparativa de modelos atómicos, analizando detalladamente las teorías que revolucionaron la ciencia.
El modelo atómico de Dalton
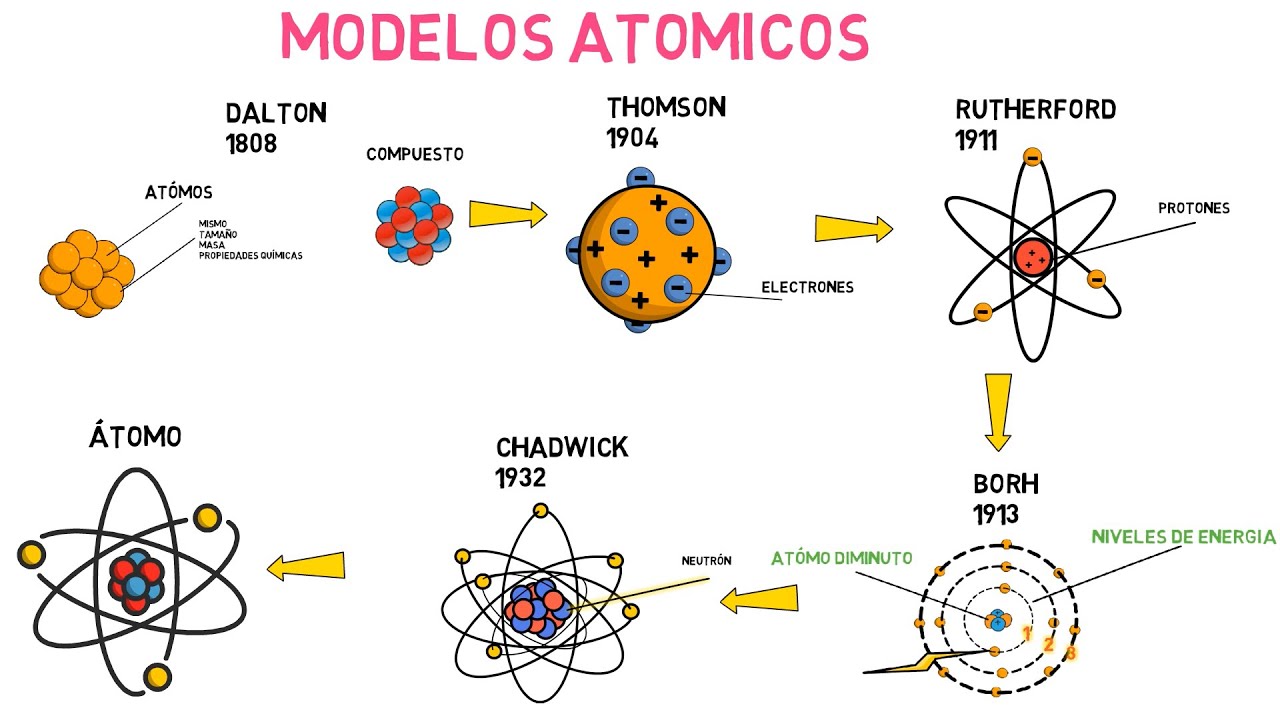
El primer modelo atómico en nuestra tabla comparativa es el modelo de Dalton. Propuesto por el científico John Dalton en el siglo XIX, este modelo establece que los átomos son partículas indivisibles y que cada elemento químico está compuesto por átomos distintos. Dalton también sugirió que los átomos se combinan en proporciones fijas para formar compuestos químicos. Este modelo sentó las bases para el estudio de la química moderna y fue un punto de partida crucial para futuras investigaciones.
El modelo atómico de Thomson
En nuestro análisis detallado, encontramos el modelo atómico de Thomson. Propuesto por el físico británico J.J. Thomson en 1897, este modelo presentó una nueva visión de los átomos. Thomson postuló que los átomos tienen una estructura esférica y que están compuestos por partículas subatómicas llamadas electrones en un mar de carga positiva. Esta teoría, conocida como el «modelo del pudín de pasas», fue un gran avance en la comprensión de la estructura atómica.
El modelo atómico de Rutherford
Continuando con nuestra tabla comparativa, nos encontramos con el modelo atómico de Rutherford. Propuesto por el físico neozelandés Ernest Rutherford en 1911, este modelo se originó a partir de un famoso experimento conocido como la «lámina de oro». Rutherford descubrió que la mayoría de las partículas alfa disparadas a través de una lámina de oro pasaban directamente, pero algunas eran desviadas en diferentes direcciones. A partir de estos resultados, Rutherford concluyó que los átomos tienen un núcleo pequeño y denso en el centro, que contiene la mayor parte de la masa, mientras que los electrones se encuentran orbitando alrededor del núcleo.
El modelo atómico de Bohr
Uno de los modelos atómicos más conocidos es el modelo de Bohr, desarrollado por el físico danés Niels Bohr en 1913. De acuerdo con este modelo, los electrones se mueven en órbitas circulares alrededor del núcleo, similar a los planetas orbitando alrededor del sol. Bohr también propuso que los electrones solo pueden ocupar ciertas órbitas definidas, conocidas como niveles de energía, y que los saltos entre órbitas emiten o absorben energía en forma de luz. Este modelo ayudó a explicar el espectro de emisión de los elementos y tuvo un impacto significativo en el campo de la física cuántica.
El modelo atómico actual: la mecánica cuántica
Nuestra tabla comparativa nos lleva al modelo atómico actual, basado en los principios de la mecánica cuántica. Esta teoría, desarrollada a partir del siglo XX, describe a los átomos y a las partículas subatómicas en términos de funciones de onda probabilísticas. La mecánica cuántica nos muestra que los electrones no se mueven en órbitas definidas, sino que existen en regiones de alta probabilidad llamadas orbitales. Además, esta teoría nos ha permitido entender mejor la dualidad de partícula-onda y los extraños fenómenos que ocurren a nivel subatómico.
En resumen, a través de nuestra tabla comparativa hemos analizado diferentes modelos atómicos que han revolucionado la ciencia. Desde el modelo de Dalton que estableció la idea de átomos indivisibles, pasando por el modelo de Thomson que introdujo la noción de partículas subatómicas, hasta llegar al modelo de Bohr que explicó la estructura de los niveles de energía. Finalmente, hemos llegado al modelo actual basado en la mecánica cuántica, que nos ha proporcionado una comprensión más profunda de la naturaleza de los átomos.
¿Por qué es importante estudiar los modelos atómicos?
El estudio de los modelos atómicos es fundamental para nuestra comprensión de la estructura y comportamiento de los átomos. Estos modelos nos han permitido avanzar en campos como la química, la física y la biología, y han sentado las bases para el desarrollo de tecnologías innovadoras.
¿Cuál es el modelo atómico más preciso?
El modelo atómico más preciso hasta la fecha es el modelo basado en la mecánica cuántica. Esta teoría ha proporcionado una descripción muy precisa de la naturaleza de los átomos y ha permitido desarrollar tecnologías como los microscopios de efecto túnel y los computadores cuánticos.
¿Cuál fue el mayor descubrimiento en la historia de los modelos atómicos?
Uno de los mayores descubrimientos en la historia de los modelos atómicos fue el experimento de la lámina de oro de Rutherford. Este experimento reveló la existencia de un núcleo pequeño y denso en el centro de los átomos, lo que cambió nuestra comprensión de la estructura atómica y abrió nuevas puertas para la física nuclear.