¿Qué son los estados de la materia y cómo se forman las moléculas?
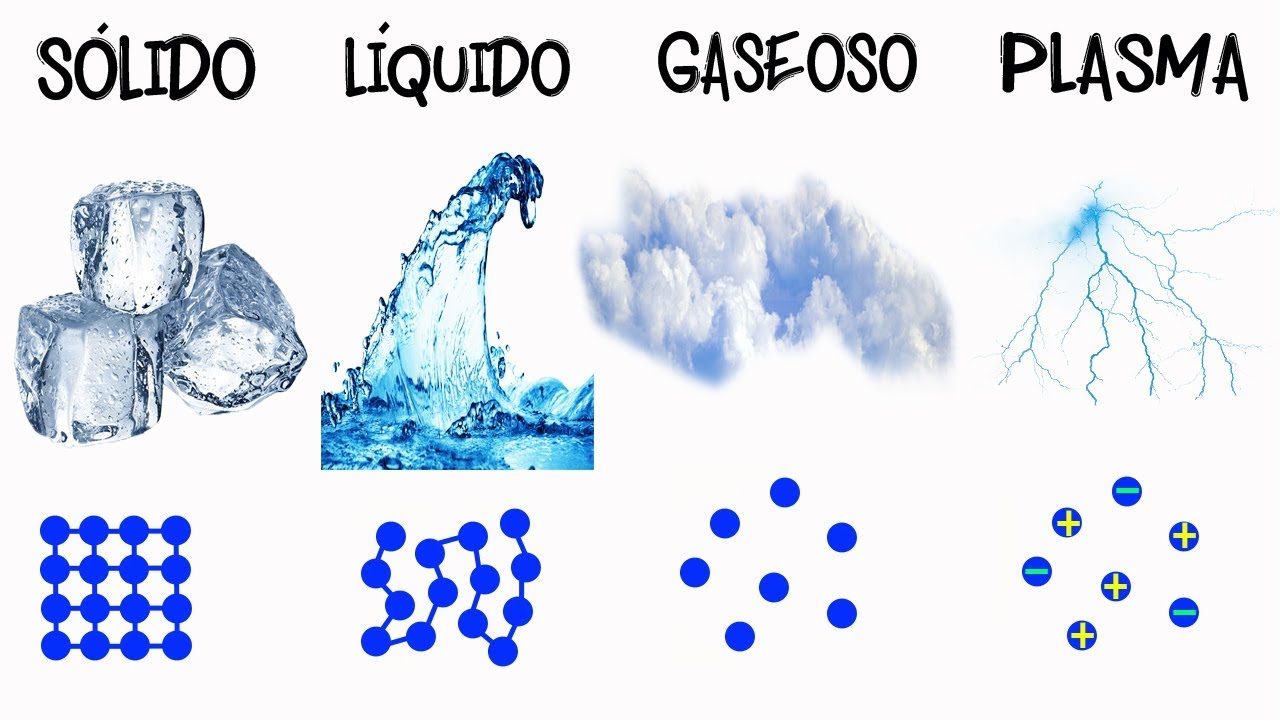
Cuando pensamos en la materia, generalmente tenemos en mente objetos tangibles como una roca o un libro. Sin embargo, la materia está compuesta por partículas microscópicas llamadas moléculas, que se unen para formar distintos estados de la materia. Estos estados son sólido, líquido y gaseoso, y cada uno tiene sus propias características y propiedades únicas.
En el estado sólido, las moléculas están muy cercanas unas a las otras y se mantienen en una posición fija. Esto les confiere a los sólidos su forma y volumen definidos. Un ejemplo clásico de un sólido es el hielo. Las moléculas de agua se organizan en una estructura regular, formando cristales que mantienen su forma hasta que se les aplique suficiente energía para romper sus enlaces y pasar a otro estado.
En cambio, en el estado líquido, las moléculas se mueven más libremente y están menos organizadas. A diferencia de los sólidos, los líquidos no tienen una forma definida, adaptándose al recipiente que los contiene. El agua es un líquido común. Sus moléculas pueden deslizarse y fluir unas sobre las otras, lo que les permite tomar la forma del recipiente en el que se encuentren.
Y finalmente, en el estado gaseoso, las moléculas están muy separadas y se mueven rápidamente en todas las direcciones. Los gases no tienen forma ni volumen definidos, ocupando completamente el espacio disponible. Un ejemplo de gas es el aire que respiramos. Las moléculas de gases como el oxígeno y el nitrógeno se mueven tan libremente que llenan cualquier espacio en el que se encuentren.
Ahora que hemos comprendido los distintos estados de la materia, es importante entender cómo se forman y transforman las moléculas para dar lugar a estos estados. Las moléculas están formadas por átomos, que son las unidades básicas de la materia. Estos átomos se unen entre sí mediante enlaces químicos para formar moléculas más grandes y complejas.
Cuando se aplica energía a las moléculas, ya sea en forma de calor o presión, pueden romperse o unirse formando nuevos enlaces. Por ejemplo, cuando calentamos un sólido de hielo, las moléculas de agua ganan energía y comienzan a moverse más rápidamente. Esto provoca que los enlaces entre las moléculas se debiliten y finalmente se rompan, lo que transforma el hielo en agua líquida.
De manera similar, si continuamos aplicando calor al agua líquida, las moléculas ganan aún más energía y se mueven aún más rápido. Eventualmente, alcanzarán una energía suficiente para romper todos los enlaces y convertirse en vapor de agua, que es el estado gaseoso.
Además de la temperatura y la presión, otros factores como la composición molecular y la fuerza de los enlaces también juegan un papel importante en la formación y transformación de los estados de la materia. Por ejemplo, algunos sólidos como el vidrio son estructuras amorfas, lo que significa que sus moléculas no tienen un patrón ordenado. En contraste, los sólidos cristalinos tienen una estructura regular y ordenada, lo que les confiere propiedades diferentes.
En resumen, los estados de la materia están determinados por la forma en que las moléculas interactúan entre sí. A medida que las moléculas ganan o pierden energía, pueden pasar de un estado a otro, cambiando sus propiedades y características físicas. Comprender este proceso nos ayuda a entender mejor el comportamiento de la materia y su relación con el mundo que nos rodea.
Propiedades y características de los estados de la materia
Cada estado de la materia tiene propiedades y características únicas que lo distinguen de los demás. Veamos más de cerca estas características para comprender mejor cómo se comportan y cómo interactúan las moléculas en cada estado.
Estado sólido:
– Forma y volumen definidos: Las moléculas en estado sólido están muy cerca unas de las otras y se mantienen en posiciones fijas, lo que les confiere forma y volumen definidos.
– Partículas ordenadas: En los sólidos cristalinos, las moléculas están organizadas en una estructura regular y repetitiva. Esto se debe a la forma en que los átomos se unen y disponen en el material.
– Baja compresibilidad: Debido a la cercanía de las moléculas, los sólidos tienen una baja capacidad para comprimirse o expandirse bajo presión.
– Punto de fusión: Los sólidos tienen un punto de fusión, es decir, una temperatura específica a la cual pasan al estado líquido. Durante el proceso de fusión, las moléculas adquieren suficiente energía para superar los enlaces y comenzar a fluir.
Estado líquido:
– No tienen forma definida: A diferencia de los sólidos, los líquidos no tienen una forma definida y toman la forma del recipiente que los contiene.
– Fluidez: Las moléculas en estado líquido pueden deslizarse y fluir unas sobre las otras, lo que les confiere a los líquidos su capacidad de fluidez. Esto permite que los líquidos se adapten a la forma del recipiente en el que se encuentren.
– Volumen definido: Aunque los líquidos no tienen una forma definida, mantienen un volumen constante. Esto se debe a la cohesión entre las moléculas, que evita que el líquido se comprima fácilmente.
– Punto de ebullición: Los líquidos tienen un punto de ebullición, es decir, una temperatura específica a la cual pasan al estado gaseoso. Durante el proceso de ebullición, las moléculas ganan suficiente energía para romper los enlaces y convertirse en gas.
Estado gaseoso:
– No tienen forma ni volumen definidos: Los gases se expanden para ocupar completamente el espacio disponible y no tienen una forma ni un volumen definidos.
– Movimiento rápido y aleatorio: Las moléculas en estado gaseoso se mueven rápidamente y en todas las direcciones. Interactúan entre sí solo cuando chocan, lo que resulta en un comportamiento caótico y aleatorio.
– Alta compresibilidad: Debido a la gran separación entre las moléculas, los gases tienen una alta capacidad de compresión. Esto significa que se pueden reducir a un volumen más pequeño al aplicarles presión.
– Punto de condensación: Los gases tienen un punto de condensación, es decir, una temperatura específica a la cual pasan al estado líquido. Durante el proceso de condensación, las moléculas pierden suficiente energía para formar enlaces y comenzar a agruparse.
Los cambios de estado y sus aplicaciones
Los cambios de estado de la materia, como la evaporación, la condensación, la solidificación y la fusión, juegan un papel importante en nuestra vida diaria y tienen aplicaciones en diversos campos. Veamos algunos ejemplos de cómo se aplican estos cambios de estado:
Evaporación y condensación:
La evaporación es el cambio de estado de líquido a gaseoso. Este proceso ocurre cuando se añade suficiente energía térmica a las moléculas del líquido, lo que las hace escapar de la superficie y convertirse en vapor. La condensación, por otro lado, es el cambio de estado de gaseoso a líquido. Este proceso ocurre cuando se retira energía térmica de un gas, lo que hace que las moléculas se agrupen y formen gotas de líquido. Estos cambios de estado son fundamentales en el ciclo del agua y en la formación de nubes y precipitaciones.
Además del ciclo del agua, la evaporación y la condensación tienen diversas aplicaciones prácticas. Por ejemplo, los sistemas de refrigeración y aire acondicionado funcionan mediante la evaporación y condensación de un refrigerante, lo que permite extraer y disipar el calor del entorno. También se utilizan en la destilación, un proceso para purificar sustancias mediante la evaporación y posterior condensación.
Solidificación y fusión:
La solidificación es el cambio de estado de líquido a sólido, mientras que la fusión es el cambio inverso, de sólido a líquido. Estos cambios de estado son comunes en la vida cotidiana, como cuando congelamos agua para obtener hielo o cuando calentamos hielo para hacer agua líquida. Además de ser utilizados en la producción y conservación de alimentos, estos cambios también se aplican en metalurgia, donde los metales se funden y solidifican para dar forma a diferentes objetos.
Otras aplicaciones de los cambios de estado:
Además de los cambios de estado mencionados anteriormente, existen otras aplicaciones importantes en diversas áreas. Por ejemplo, la sublimación es el cambio de estado de sólido a gaseoso sin pasar por el estado líquido. Este proceso se utiliza en la industria alimentaria para la deshidratación de alimentos, preservando su sabor y propiedades.
También, la deposición es el cambio de estado de gaseoso a sólido sin pasar por el estado líquido. Es utilizado para crear capas delgadas de distintos materiales en la fabricación de chips de computadora y otros dispositivos electrónicos.
¿Existen otros estados de la materia además de sólido, líquido y gaseoso?
Sí, además de los tres estados comunes de la materia, también existen otros estados menos conocidos. Algunos ejemplos son el plasma, el estado superfluido y el condensado de Bose-Einstein. Estos estados se encuentran en condiciones extremas de temperatura y presión, y tienen características y propiedades únicas.
¿Qué es el plasma y dónde se encuentra?
El plasma es un estado de la materia en el cual los átomos se separan en electrones y núcleos cargados positivamente llamados iones. Se encuentra en entornos muy energéticos, como el interior del Sol y en lámparas de plasma. También es abundante en fenómenos naturales como los relámpagos y las auroras boreales.
¿Cómo se pueden cambiar los estados de la materia?
Los estados de la materia pueden cambiar mediante la adición o reducción de energía térmica, cambios en la presión y alteraciones en la composición de las moléculas. Estos cambios pueden ser provocados por diversos factores, como el calentamiento, enfriamiento, evaporación, condensación, solidificación y fusión.
¿Cuál es el punto de fusión y el punto de ebullición de una sustancia?
El punto de fusión es la temperatura a la cual una sustancia pasa del estado sólido al líquido, mientras que el punto de ebullición es la temperatura a la cual una sustancia pasa del estado líquido al gaseoso. Estos puntos de transición son características específicas de cada sustancia y pueden variar dependiendo de la presión a la que se encuentre la sustancia.
¿Por qué las moléculas en el estado gaseoso se mueven aleatoriamente?
El movimiento aleatorio de las moléculas en el estado gaseoso se debe a la alta energía cinética que poseen. Las moléculas están en un constante movimiento, chocando unas con otras y rebotando en diferentes direcciones. Esto se conoce como movimiento browniano y es el resultado de la energía térmica de las moléculas.
En conclusión, los estados de la materia y las moléculas que los componen son fascinantes fenómenos que ocurren en nuestra vida cotidiana. Desde la formación de sólidos con estructuras cristalinas hasta la aleatoriedad del movimiento de las moléculas en los gases, la materia nos rodea en diferentes formas y estados. Comprender cómo se forman y transforman las moléculas nos permite apreciar mejor el mundo que nos rodea y aplicar este conocimiento en diversas áreas, desde la química y la física hasta la tecnología y la industria.