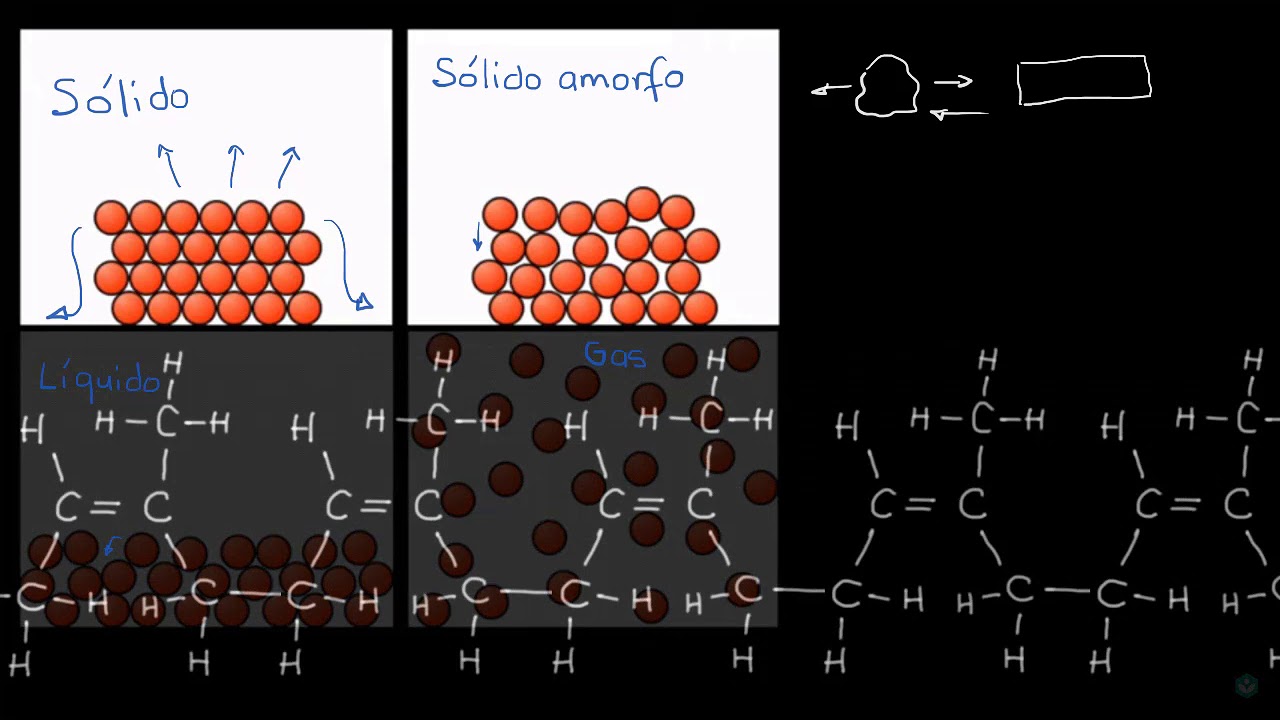
La importancia de la cohesión en los sólidos
Los sólidos son materiales que tienen una estructura ordenada y están formados por partículas cuyos átomos o moléculas están unidos firmemente entre sí. La fuerza que mantiene unidas estas partículas se conoce como cohesión y es fundamental para entender las propiedades y comportamiento de los sólidos.
La estructura cristalina: una organización perfecta
La cohesión en los sólidos se manifiesta a través de la estructura cristalina, que es una organización perfecta y regular de átomos, iones o moléculas. En este tipo de estructura, las partículas están dispuestas en un arreglo tridimensional repetitivo, similar a los ladrillos en una pared o las baldosas en un piso.
¿Cómo se forman los cristales?
La formación de un cristal comienza a nivel microscópico, cuando las partículas que lo conforman se acercan lo suficiente para que las fuerzas de atracción entre ellas empiecen a ser significativas. Estas fuerzas de atracción pueden variar dependiendo del tipo de partículas y de la sustancia de la que estén hechas.
Cuando las partículas se acercan, los átomos, iones o moléculas que las componen empiezan a interactuar entre sí, estableciendo enlaces químicos o fuerzas de dispersión. Estos enlaces o fuerzas de dispersión son los responsables de la cohesión entre las partículas, manteniéndolas unidas y generando la estructura cristalina característica de los sólidos.
Tipos de interacciones entre partículas
Existen diferentes tipos de interacciones que pueden ocurrir entre las partículas en el estado sólido. Algunos de los más comunes son:
1. Fuerzas iónicas: ocurren entre iones con carga opuesta, como en los compuestos iónicos. Los cationes y aniones se atraen mutuamente, formando una estructura cristalina altamente ordenada.
2. Enlaces covalentes: se forman cuando dos átomos comparten electrones. Esto ocurre en sustancias como el diamante y el grafito, donde los átomos de carbono están unidos mediante enlaces covalentes fuertes.
3. Fuerzas de Van der Waals: son fuerzas de atracción débiles que se dan entre moléculas polares o no polares. Estas fuerzas son responsables de la cohesión en sustancias como el hielo o el azufre.
4. Puentes de hidrógeno: son interacciones fuertes entre una molécula que contiene átomos de hidrógeno unidos a átomos más electronegativos y otra molécula con electrones disponibles para formar enlaces de hidrógeno. Este tipo de interacción es crucial en la estructura del ADN y las proteínas.
¿Por qué es importante entender la cohesión en los sólidos?
El estudio de la cohesión en los sólidos es esencial para comprender y controlar muchas propiedades y fenómenos que ocurren en nuestro entorno. Al conocer las fuerzas que mantienen unidas a las partículas en el estado sólido, podemos entender por qué ciertos materiales tienen determinadas propiedades físicas y químicas, como su dureza, conductividad eléctrica, punto de fusión, entre otras.
Además, el entendimiento de la cohesión en los sólidos nos permite diseñar materiales con propiedades específicas, como los superconductores o los materiales utilizados en la fabricación de dispositivos electrónicos. También nos ayuda a comprender fenómenos naturales, como la formación de minerales o la estructura de los cristales en los seres vivos.
1. ¿Qué es la cohesión en los sólidos?
La cohesión en los sólidos es la fuerza que mantiene unidas a las partículas en la estructura cristalina. Es responsable de las propiedades y comportamiento de los sólidos.
2. ¿Cuáles son los tipos de interacciones entre partículas en los sólidos?
Existen diferentes tipos de interacciones entre partículas en los sólidos, como fuerzas iónicas, enlaces covalentes, fuerzas de Van der Waals y puentes de hidrógeno.
3. ¿Por qué es importante entender la cohesión en los sólidos?
Entender la cohesión en los sólidos es fundamental para comprender y controlar propiedades físicas y químicas de los materiales, diseñar materiales con propiedades específicas y comprender fenómenos naturales.